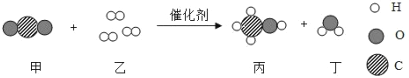
题目内容
【题目】我国每年报废的手机超过1亿部。废旧手机的电路板中含有多种金属,随意丢弃会造成资源浪费并污染土壤和水体。某手机电路板中含有Sn、Fe、Cu、Au、Ag等金属,如图是某工厂回收其中部分金属的流程图。(其中Sn、Au在化合物中的化合价分别为+2价、+3价)
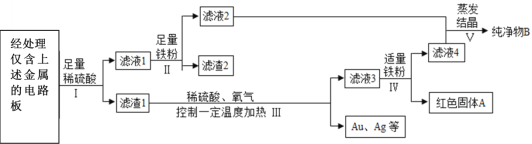
(1)过程Ⅰ、Ⅱ、Ⅳ均涉及的操作是________,该操作需要用到一种金属材料制成的仪器是___________。
(2)写出过程Ⅱ中反应的化学方程式__________、_______。
(3)写出过程Ⅲ中反应的化学方程式______________。
(4)滤液4的主要成分(水除外)是________________。
【答案】过滤 铁架台 Fe+H2SO4=FeSO4+H2 ↑ Fe+SnSO4=FeSO4+Sn 2Cu+2H2SO4+O2![]() 2CuSO4+2H2O 硫酸亚铁
2CuSO4+2H2O 硫酸亚铁
【解析】
(1)由图可知,操作是将固体与液体进行分离,该操作为过滤,故填过滤;
过滤时用到的仪器有:铁架台、烧杯、漏斗、滤纸、玻璃棒,其中由金属材料制成的仪器是铁架台,故填铁架台。
(2)由图可知,滤液1中含有硫酸亚铁,硫酸锡和硫酸,则过程Ⅱ中反应是铁与硫酸反应生成硫酸亚铁和氢气,以及铁与硫酸锡反应生成硫酸亚铁和锡,故反应的化学方程式写为:Fe+H2SO4=FeSO4+H2 ↑、Fe+SnSO4=FeSO4+Sn。
(3)过程Ⅲ中反应是铜、稀硫酸和氧气在加热的条件下反应生成硫酸铜和水,故反应的化学方程式写为:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
(4)由图可知,滤液4的主要成分是硫酸亚铁,故填硫酸亚铁。

【题目】某化学兴趣小组在实验室中模拟炼铁,他们把焦炭和氧化铁粉末混合加强热,得到无色气体A和黑色粉末B(如图所示)。
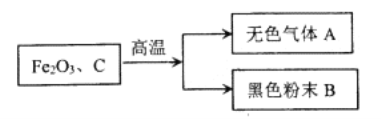
(1)他们炼铁反应的化学方程式是__________。
(2)经分析得知,无色气体A不含有单质,黑色粉末B的成分是一种或两种单质。甲、乙两个兴趣小组分别对无色气体A和黑色粉末B的成分进行探究。
(猜想与假设)甲组认为无色气体A中可能有CO2,也可能有CO。
乙组认为黑色粉末的成分中存在以下两种情况:①只含有______。②含有铁和碳。
(实验探究)(1)为验证甲组的猜想,同学们按下图所示装置进行实验。
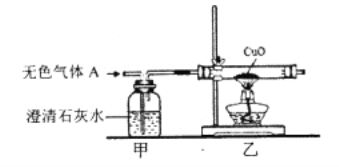
装置甲的作用是_______。装置乙的作用是_______。当看到甲中澄清石灰水变浑浊,乙中____后,可以确定无色气体A是CO2、CO的混合气体。
有同学提出把甲、乙交换位置,让气体A先通过热的氧化铜也可以达到同样的实验目的,你的判断是_____(填“可以”或“不可以”)。
(2)为验证乙组中假设②是否成立,设计实验用物理和化学两种方法完成以下探究。
实验方法 | 实验操作 | 实验现象 | 实验结论 |
物理方法 | _______ | _______ | 假设二成立 |
化学方法 | ______ | 部分黑色粉末溶解,产生无色气泡 | 假设二成立 |
(交流反思)针对甲组实验存在的缺陷,同学们一起进行了改进,解决了污染环境问题。