题目内容
原水是取自天然水体或蓄水水体,如河流、湖泊、池塘或地下蓄水层等,用作供水水源的水,通常原水含有较多的可溶性钙镁化合物,而我国饮用水质量标准规定必须符合下表中要求:| pH | Ca2+、Mg2+总数 | 细菌总数 |
| 6.5~8.5 | <2.709×1021个?L-1? | <100个?mL-1? |

(1)某自来水厂所取原水中含较多的CaCl2、MgCl2、Ca(HCO3)2 等,加入过量生石灰时一级沉降池中发生了若干化学反应,如Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O请写出其它化学反应的化学方程式:______.(任写1个)
(2)絮凝剂在原水处理流程中的作用是:______;通入CO2的目的是______和______.
(3)小明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是______.
(2)絮凝剂在原水处理流程中的作用是吸附水中悬浮杂质使之沉降;通入CO2的目的是除去过量的Ca(OH)2和调节pH;
(3)根据原水的硬度大进行解答.
解答:解:(1)氧化钙和水反应生成氢氧化钙,化学反应的化学方程式CaO+H2O=Ca(OH)2;氢氧化钙和氯化镁反应生成氯化钙和氢氧化镁沉淀,化学反应的化学方程式、Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;
(2)絮凝剂在原水处理流程中的作用是吸附水中悬浮杂质使之沉降;通入CO2的目的是除去过量的Ca(OH)2和调节pH;
(3)原水的硬度大,所以利用家中常用物质肥皂水鉴别.
故答案为:(1)CaO+H2O=Ca(OH)2;
(2)吸附水中悬浮杂质使之沉降;除去过量的Ca(OH)2;调节pH.
(3)肥皂水.
点评:本题以净化水为中心,考查了过滤操作、硬水和软水的转化方法以及物理变化和化学变化的判断,解题时要针对结合所学习的基础知识,经过仔细分析后再作回答.

 阅读快车系列答案
阅读快车系列答案原水是取自天然水体或蓄水水体,如河流、湖泊、池塘或地下蓄水层等,用作供水水源的水,通常原水含有较多的可溶性钙镁化合物,而我国饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+、Mg2+总数 | 细菌总数 |
| 6.5~8.5 | <2.709×1021个?L-1? | <100个?mL-1? |
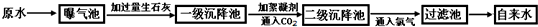
(1)某自来水厂所取原水中含较多的CaCl2、MgCl2、Ca(HCO3)2 等,加入过量生石灰时一级沉降池中发生了若干化学反应,如Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O请写出其它化学反应的化学方程式:________.(任写1个)
(2)絮凝剂在原水处理流程中的作用是:________;通入CO2的目的是________和________.
(3)小明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是________.
原水是取自天然水体或蓄水水体,如河流、湖泊、池塘或地下蓄水层等,用作供水水源的水,通常原水含有较多的可溶性钙镁化合物,而我国饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+ 、Mg2+总数 | 细菌总数 |
| 6.5~8.5 | < 2.709×1021个·L-1 | <100个·mL-1 |
以下是原水处理成自来水的工艺流程示意图:
![]()
(1)某自来水厂所取原水中含较多的CaCl2 、MgCl2 、Ca(HCO3)2 等,加入过量生石灰时一级沉降池中发生了若干化学反应,如Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O请写出其它化学反应的化学方程式: 。(任写1个)
(2)絮凝剂在原水处理流程中的作用是: ;通入CO2的目的是 和 。
(3)小![]() 明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是 。
明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是 。
原水是取自天然水体或蓄水水体,如河流、湖泊、池塘或地下蓄水层等,用作供水水源的水,通常原水含有较多的可溶性钙镁化合物,而我国饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+ 、Mg2+总数 | 细菌总数 |
| 6.5~8.5 | < 2.709×1021个·L-1 | <100个·mL-1 |
以下是原水处理成自来水的工艺流程示意图:
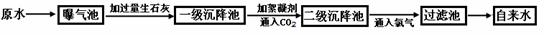
(1)某自来水厂所取原水中含较多的CaCl2 、MgCl2 、Ca(HCO3)2 等,加入过量生石灰时一级沉降池中发生了若干化学反应,如Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O请写出其它化学反应的化学方程式: 。(任写1个)
(2)絮凝剂在原水处理流程中的作用是: ;通入CO2的目的是 和 。
(3)小明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是 。
