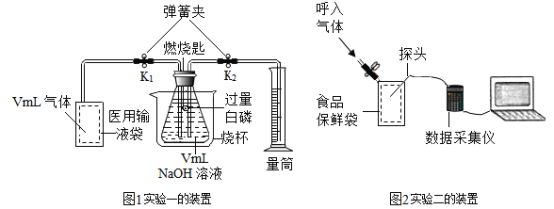
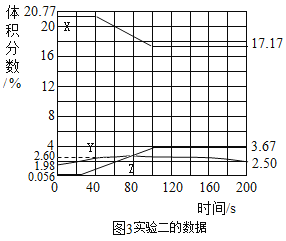
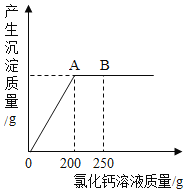
题目内容
【题目】取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为15.6g,其中钙元素和碳元素的质量比为20:3,向剩余固体中加入100g稀盐酸,恰好完全反应,所得溶液质量为11.2g,则加热前碳酸钙的质量为( )
A.15g
B.18g
C.20g
D.30g
【答案】C
【解析】
剩余固体中的碳元素全部在碳酸钙中,加入稀盐酸后碳酸钙和稀盐酸反应生成二氧化碳,所以根据质量守恒定律可以计算出二氧化碳的质量,进而可以计算出碳元素的质量,然后可以计算出钙元素的质量,然后根据钙元素的质量守恒可以计算出碳酸钙的质量。
反应生成二氧化氮质量为:100g+15.6g-111.2g=4.4g
故剩余固体中碳元素的质量为:4.4g×(![]() ×100%)=1.2g
×100%)=1.2g
所以钙元素的质量为:1.2g×![]() =8g
=8g
根据钙元素的质量守恒可以得出碳酸钙的质量为:8g÷(![]() ×100%)=20g
×100%)=20g
故选:C。

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
【题目】下列实验操作能达到实验目的的是( )
选项 | 物质 | 目的 | 主要实验操作 |
A |
| 鉴别 | 分别用燃着的木条试验,观察现象 |
B |
| 检验 | 取样,滴加 |
C |
| 除杂 | 加入 |
D |
| 分离 | 加入过量的 |
A. AB. BC. CD. D