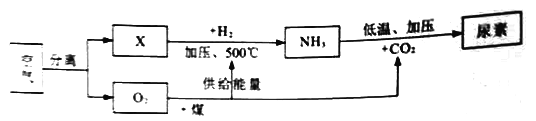
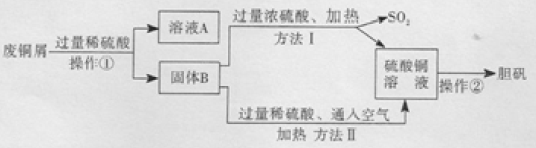
题目内容
【题目】某学习小组对人体吸入的空气与呼出的气体,进行了如下探究
(提出问题) 人体吸入的空气与呼出的气体组成有什么不同?
(查阅资料)
通常条件下,白磷与氢氧化钠溶液不反应。
(实验操作、记录、分析)
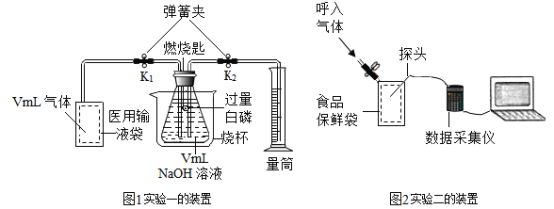
实验一:
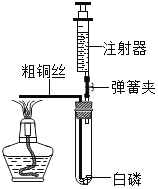
(1)先检查装置的_________,装入试剂,在医用输液袋中装入VmL气体,连接装置。
(2)打开弹簧夹_____________,缓慢将袋中的气体全部排除。读出量筒中液体体积为V1mL。氢氧化钠发生反应的化学方程式是__________________。
(3)关闭弹簧夹 K1、K2,再(填操作方法),以促使白磷迅速燃烧。 待瓶中气体冷却至室温,打开 K2。读出量筒中液体体积为 V2mL,其数值等于已反应的_________之外的气体总体积。
实验二:
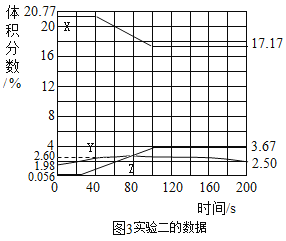
(4)把氧气、二氧化碳、水蒸气(测湿度)探头放入袋中,开始采集数据,然后向袋内呼出气体。采集的数据经处理如图,表示二氧化碳体积分数变化的是___________(填“X”、“Y”、“Z”)。Y 的体积分数在 60s 之后逐渐减小的原因是___________________________。
(数据处理)
(5)实验一中,二氧化碳的体积分数是__________,氧气的体积分数是__________。
(6)实验二中,200s 时没有采集数据的所有气体的总体积分数为_________。
(评价与反思)
(7)有人认为教材中空气成分的“其它气体和杂质”主要是指水蒸气,由实验二判断此说法是_________(填“正确”或“错误”)的,理由是__________________。
【答案】气密性 K1、K2 2NaOH+CO2=Na2CO3+H2O O2、CO2 Z 水蒸气冷凝 ![]()
![]() 76.66% 错误 由实验 2 可知,空气中水的体积分数为 1.98%,而空气成分的气体杂质体积分数为 0.03%
76.66% 错误 由实验 2 可知,空气中水的体积分数为 1.98%,而空气成分的气体杂质体积分数为 0.03%
【解析】
(1)先检查装置的气密性;
(2)打开弹簧夹K1、K2,缓慢将袋中的气体全部排除。读出量筒中液体体积为V1mL。氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式是2NaOH+CO2=Na2CO3+H2O;
(3)燃烧需要满足的条件是可燃物,氧气,温度达到可燃物的着火点。白磷是可燃物,空气中有氧气,还需要的条件是温度达到可燃物的着火点。故进行的操作是向烧杯中加入热水;燃烧需要消耗氧气,与氢氧化钠反应需要消耗二氧化碳。故读出量筒中液体体积为 V2mL,其数值等于已反应的O2、CO2之外的气体总体积;
(4)人体呼出气体的主要成分是氧气、二氧化碳、水蒸气,且氧气含量减少,二氧化碳与水蒸气含量增大,二氧化碳的含量大于水蒸气的含量,故Z表示二氧化碳体积分数变化;Y 的体积分数在 60s 之后逐渐减小的原因是水蒸气冷凝;
(5)二氧化碳的体积为(V-V1) mL,其体积分数为![]() ;氧气的体积是(V1- V2),其体积分数为
;氧气的体积是(V1- V2),其体积分数为![]() ;
;
(6)气体的总质量分数为100%,其中x占17.17%,y占2.50%,z占3.67%,故实验二中,200s 时没有采集数据的所有气体的总体积分数为100%-17.17%-2.50%-3.67%=76.66%;
(7)有人认为教材中空气成分的“其它气体和杂质”主要是指水蒸气,由实验二判断此说法是错误的;理由是由实验 2 可知,空气中水的体积分数为 1.98%,而空气成分的气体杂质体积分数为 0.03%。