题目内容
【题目】(1)用化学用语回答:
①氮气分子______;②地壳中含量最多的元素___;③硫酸亚铁中的阳离子是_______;
④二氧化氯(ClO2)是一种常见的漂白剂,标出其中氯元素的化合价___。
(2)下列是实验小组进行的粗盐提纯实验。
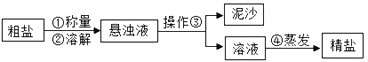
A.操作③的名称是______;操作②③④都用到同一种仪器,它在操作②中的作用是________。
B.工业上通过电解饱和食盐水制备氢氧化钠,化学方程式为:2NaCl + 2H2O ![]() 2NaOH + Cl2↑+ M↑,则M的化学式为__________。
2NaOH + Cl2↑+ M↑,则M的化学式为__________。
【答案】 N2 O Fe2+ ![]() 过滤 加快溶解(或充分溶解) H2
过滤 加快溶解(或充分溶解) H2
【解析】(1)①氮气的化学式可表示氮分子:符号为N2;②地壳中含量最多的元素是氧元素,——O;③离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写;硫酸亚铁中的阳离子是亚铁离子——Fe2+;④元素化合价的书写:在元素符号的正上方标化合价的数值,正负号在左,数字在右。二氧化氯(ClO2)中氯元素的化合价![]() 。(2)A.操作③的目的是将难溶性固体与液体分离,操作名称是过滤;操作②③④都用到同一种仪器,它在操作②中的作用是玻璃棒。B.据质量守恒定律可知反应前后原子的种类个数不变,工业上通过电解饱和食盐水制备氢氧化钠,化学方程式为:2NaCl + 2H2O
。(2)A.操作③的目的是将难溶性固体与液体分离,操作名称是过滤;操作②③④都用到同一种仪器,它在操作②中的作用是玻璃棒。B.据质量守恒定律可知反应前后原子的种类个数不变,工业上通过电解饱和食盐水制备氢氧化钠,化学方程式为:2NaCl + 2H2O ![]() 2NaOH + Cl2↑+ M↑,则M的化学式为H2。
2NaOH + Cl2↑+ M↑,则M的化学式为H2。

 阅读快车系列答案
阅读快车系列答案【题目】下表列出了固体物质A在不同温度时的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是______________(填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为_____________(填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线应是右图中的___________(填“甲”或“乙”);
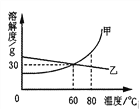
(3)80℃时,配制一定量A物质的溶液,将其降温到60℃,是否有固体析出?____________(填“有”、 “没有”或“不确定”)。