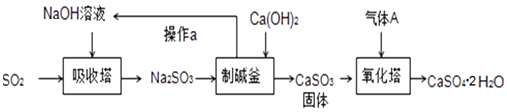
题目内容
【题目】一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl﹣、OH﹣和SO ![]() 离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:
离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
A.溶液中一定含有H+、Ba2+、Cl﹣ , 一定不含有Na+、Fe3+、OH﹣、SO ![]()
B.溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有Na+、OH﹣和SO ![]()
C.溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有OH﹣、SO ![]() ,可能含有Na+
,可能含有Na+
D.溶液中一定含有H+、Ba2+、Na+、Fe3+ , 一定不含有OH﹣、SO ![]() ,可能含有Cl﹣
,可能含有Cl﹣
【答案】C
【解析】解:①经测定,溶液的pH=1,该溶液显酸性,一定含有H+、一定不含有OH﹣;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.一定含Fe3+;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成,证明滤液中含有Ba2+ , 则一定不含有SO ![]() ,
,
溶液中阴阳离子平衡,所以一定含有Cl﹣、
综上所述,溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有OH﹣、SO ![]() ,可能含有Na+
,可能含有Na+
故选:C.

练习册系列答案
相关题目