��Ŀ����
����Ŀ����Դ��������������������ᷢչ������أ���������Դ��ʵ����������չ����Ҫ����ҵ�Ͽ��ö�������ͨ�����й��չ�����ȡ������ 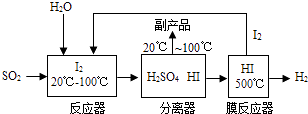
��1��H2O��������Ԫ�ص�������Ϊ ��
��2���������з�����ĸ���Ʒ�� �� �����������ܱ�ѭ�����õ�����Ϊ ��
��3��д��Ĥ��Ӧ����HI���巢���ֽⷴӦ�Ļ�ѧ����ʽ����ע����Ӧ��������
��4��������д��Ӧ���з�����Ӧ�Ļ�ѧ����ʽ������Ӧ��������Ҫ��
���𰸡�
��1��8��1
��2��H2SO4��I2
��3��2HI ![]() H2+I2
H2+I2
��4��SO2+I2+2H2O=H2SO4+2HI
���������⣺��1���������и�Ԫ��������=��Ԫ�ص����ԭ��������ԭ�Ӹ���֮�ȣ�����ˮ����Ԫ�غ���Ԫ�ص�������Ϊ16��2=8��1�����Դ��ǣ�8��1����2���ɹ�������ͼ�п��Կ����������з�����ĸ���Ʒ�����ᣬ�����������ܱ�ѭ�����õ�������I2 ��
���Դ��ǣ�H2SO4��I2����3��������֪��HI������500��ʱ�����ֽⷴӦ���ɵ���������ʷ�Ӧ�Ļ�ѧ����ʽΪ��2HI ![]() H2+I2����4���ɿ�ͼ��������Ӧ��Ӧ���Ƕ�������ˮ��ѭ�������ĵⵥ�ʣ���Ӧ��������͵⻯�⣬�ʷ�Ӧ�ķ���ʽΪ��SO2+I2+2H2O=H2SO4+2HI��
H2+I2����4���ɿ�ͼ��������Ӧ��Ӧ���Ƕ�������ˮ��ѭ�������ĵⵥ�ʣ���Ӧ��������͵⻯�⣬�ʷ�Ӧ�ķ���ʽΪ��SO2+I2+2H2O=H2SO4+2HI��
�����㾫����������Ĺؼ�����������������ȡ�ͼ�������֪ʶ������������ʵ�����Ʒ�ԭ����Zn + H2SO4 = ZnSO4 +H2����Zn + 2HCl = ZnCl2 +H2��������Ũ�����ԭ�� Ũ������ǿ�ӷ��� ��������Ũ����������ԭ�� Ũ�����������ǿ�����ԣ��Լ�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����⣬�˽�ע�⣺a����ƽ b������ c�����ţ�