题目内容
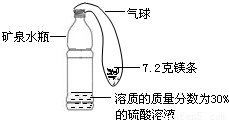
通常状况下,氢气是所有气体中密度最小的.因此氢气以前曾被用于飞艇和载人气球.某实验小组同学设计了下图装置模拟氢气探空气球(装置中气球固定在矿泉水瓶上).将气球中的镁条加入到硫酸溶液中,恰好完全反应.(1)反应生成氢气的质量;
(2)所用硫酸溶液的质量;
(3)如果该装置放在天平上称量,所得数值等于反应前装置和药品的质量之和. (填能或不能)
【答案】分析:(1)根据镁与硫酸反应的化学方程式和镁的质量,即可计算出反应生成氢气的质量;
(2)根据镁与硫酸反应的化学方程式和镁的质量,即可计算出参与反应的H2SO4的质量;然后根据“溶液质量=溶质质量÷溶质质量分数”计算即可;
(3)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因为反应中生成的气体逸出,故反应后物质质量总和小于反应前物质质量总和.
解答:解:设反应生成氢气的质量为x,参与反应的H2SO4的质量为y,
Mg+H2SO4═MgSO4+H2↑
24----98--------2
7.2g---y--------x
(1)∴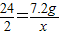 ,
,
解之得:x=0.6g;
(2)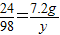
解之得:y=29.4g;
29.4g÷30%=98g;
(3)因为生成的气体逸出,故反应后物质质量总和小于反应前物质质量总和.
故答案为:(1)0.6g;(2)98g;(3)不能.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式以及质量守恒定律进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)根据镁与硫酸反应的化学方程式和镁的质量,即可计算出参与反应的H2SO4的质量;然后根据“溶液质量=溶质质量÷溶质质量分数”计算即可;
(3)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因为反应中生成的气体逸出,故反应后物质质量总和小于反应前物质质量总和.
解答:解:设反应生成氢气的质量为x,参与反应的H2SO4的质量为y,
Mg+H2SO4═MgSO4+H2↑
24----98--------2
7.2g---y--------x
(1)∴
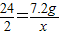 ,
,解之得:x=0.6g;
(2)
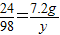
解之得:y=29.4g;
29.4g÷30%=98g;
(3)因为生成的气体逸出,故反应后物质质量总和小于反应前物质质量总和.
故答案为:(1)0.6g;(2)98g;(3)不能.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式以及质量守恒定律进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目


 →⑨→⑧→⑥
→⑨→⑧→⑥