题目内容
(2012?阜新)某工厂化验室要中和含硫酸9.8%的工业废水500g,需要多少克氢氧化钠?如果用含氢氧化钠2%的废碱液来中和,需要多少克废碱液?
分析:根据酸碱中和的化学反应方程式,将硫酸的质量代入方程式可计算氢氧化钠的质量,再根据质量分数的概念可计算需要含氢氧化钠为2%废液的质量.
解答:解:参加反应硫酸的质量9.8%×500g=49g
设需要氢氧化钠的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 49g
=
x=40g
含氢氧化钠为2%废液的质量为40g÷2%=2000g
答:需要氢氧化钠质量为40g,需要2000g废碱液.
设需要氢氧化钠的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 49g
| 80 |
| x |
| 98 |
| 49g |
x=40g
含氢氧化钠为2%废液的质量为40g÷2%=2000g
答:需要氢氧化钠质量为40g,需要2000g废碱液.
点评:本题考查学生利用化学反应方程式的计算,明确纯物质的纯质量可代入化学反应方程式计算,并熟悉质量分数的概念来解答本题.

练习册系列答案
相关题目
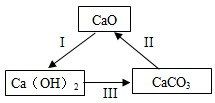 (2012?阜新)归纳和总结是学习化学的重要方法.某校化学小组的同学在复习CaO、Ca(OH)2、CaCO3的化学性质时,归纳出他们之间的转化关系.
(2012?阜新)归纳和总结是学习化学的重要方法.某校化学小组的同学在复习CaO、Ca(OH)2、CaCO3的化学性质时,归纳出他们之间的转化关系.

