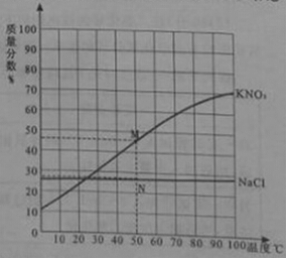
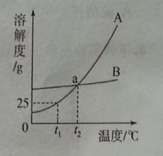
题目内容
【题目】轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙膏也常用它作摩擦剂。目前轻质碳酸钙的生产主要是碳化法,工艺流程见下图:
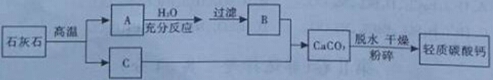
请分析轻质碳酸钙的生产流程,回答下列问题:
(1)物质B的化学式为 ;
(2)在A→B之间,过滤操作的目的是 ;
(3)在B+C→CaCO3的过程中,应控制物质C的流量,原因是 (用化学方程式表示);
(4)生产轻质碳酸钙的方法很多请再设计一种制备方法 (用化学方程式表示)。
【答案】Ca(OH)2 ;将Ca(OH)2与水分离 ;CaCO3+CO2+H2O=Ca(HCO3)2 ; Na2CO3+CaCl2=CaCO3↓+2NaCl
【解析】
试题分析:分析流程发生的化学反应:石灰石中的主要成分是碳酸钙,高温分解生成二氧化碳和氧化钙,A为氧化钙与水反应生成的氢氧化钙微溶于水,得到悬浊液,过滤得到澄清石灰水,与C二氧化碳反应生成碳酸钙沉淀和水,经脱水干燥粉碎得到轻质碳酸钙。故(1)物质B的化学式Ca(OH)2;(2)因为得到悬浊液,过滤操作的目的是使没溶解的氢氧化钙和溶液分离;(3)在B+C→CaCO3的过程中,应控制物质C的流量,因为过量的二氧化碳能与碳酸钙和水反应生成可溶于水的碳酸氢钙,减少碳酸钙的生成;(4)生成碳酸钙的方法很多如:Na2CO3与CaCl2或氢氧化钙反应生成CaCO3,注意考虑成本、转化率、能源、污染等方面。

【题目】某实验小组对实验室制取氢气的反应原理进行探究。
【知识回顾】能产生氢气的化学反应有: ①水电解 ②活泼金属与酸反应
【讨论交流】反应①的化学方程式 ;同学们讨论后认为该反应不适用于实验室制取氢气。
【实验探究】为了探究哪种物质更适合用于实验室制取氢气,大家设计了如下实验:
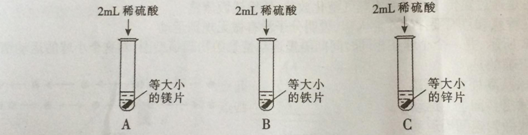
【分析与结论】填写实验报告。
实验 | 实验现象 | 实验结论 |
A | 剧烈反应,迅速产生大量气泡,试管外壁 | 反应速率过快,气体不便收集,不能用于实验室制取氢气 |
B | 缓慢产生少量气泡 | 反应速率过慢,不能用于实验室制取氢气 |
C | 较快产生大量气泡,试管外壁发热 |
通过实验得出,适合实验室制取氢气的化学反应方程式为 ;
【知识拓展】(1)确定实验室制取气体的反应原理时,要考虑诸多因素,如反应的快慢、收集的难易、 等。
(2)用稀盐酸制取氢气时,制得的气体中可能会增加的杂质为 。
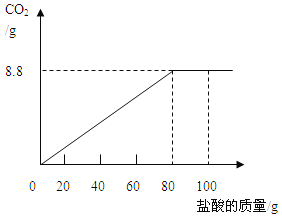
【题目】(10分)钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂说明书的部分信息如图所示。现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图像如下。请根据有关信息回答问题。

第1次 | 第3次 | 第4次 | |
加入盐酸的质量(g) | 20 | 20 | 20 |
剩余固体的质量(g) | 35 | a | 20 |
![]() (1)人体缺钙易出现的疾病是 ,这时除在医生指导下服用保健药剂外,日常生活中要多摄入 等食物。
(1)人体缺钙易出现的疾病是 ,这时除在医生指导下服用保健药剂外,日常生活中要多摄入 等食物。
(2)该品牌补钙药剂中CaCO3的质量分数是 ,a的数值为 。
(3)求该盐酸中溶质的质量分数为(写出计算过程,计算结果保留一位小数)。