题目内容
【题目】如图为A、B、C三种物质的溶解度曲线,回答下列问题。
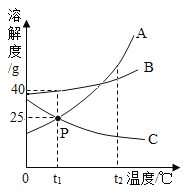
A和C的溶解度相等时的温度是____________°C;t1°C时,70gB的饱和溶液稀释到20%,需加水____g;将t2° C时A、C的饱和溶液降温到t1°C,所得溶液的溶质质量分数A_________C(填“大于”“小于”或“等于”)。
【答案】t1 30 大于
【解析】
由题意,当两种物质的溶解度曲线出现交点时两种物质的溶解度相等,根据A、C两种物质的溶解度曲线可知,A和C的溶解度相等时的温度是t1°C;
根据B的溶解度曲线可知,t1°C时,B的溶解度为40g,即t1°C时,100g水中溶解40gB达到饱和,t1°C时,要将70gB的饱和溶液稀释到20%,设需加水的质量为![]() ,则有
,则有![]() ,解得
,解得![]() ,故需加水的质量为30g;
,故需加水的质量为30g;
根据A、C两种物质的溶解度曲线可知,A的溶解度随着温度的升高而增大,C的溶解度随着温度的升高而减小,将t2° C时A、C的饱和溶液降温到t1°C,A仍为饱和溶液,有晶体析出,C变为不饱和溶液,溶质的质量分数不变,一定温度下饱和溶液的溶质分数=![]() ,溶解度越大,质量分数越大,t1℃时A的溶解度大于t2℃时C的溶解度,因此将t2° C时A、C的饱和溶液降温到t1°C,所得溶液的溶质质量分数A大于C。
,溶解度越大,质量分数越大,t1℃时A的溶解度大于t2℃时C的溶解度,因此将t2° C时A、C的饱和溶液降温到t1°C,所得溶液的溶质质量分数A大于C。

【题目】洁厕灵的有效成分是盐酸。洁厕灵中HCl的质量分数可用NaHCO3溶液来测定(假设洁厕灵中除HCl外的其他成分不与NaHCO3反应)。向锥形瓶加入50g洁厕灵,然后分五次加入NaHCO3溶液,每次加入NaHCO3溶液后均充分反应,且气体全部逸出。实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入NaHCO3溶液的质/g | 40 | 40 | 40 | 40 | 40 |
反应后锥形瓶中剩余物的总质量/g | 88.9 | 127.8 | 166.7 | 205.6 | 245.6 |
请计算:
(1)第一次加入40 g NaHCO3溶液后,生成CO2的质量为多少g。
(2)该洁厕灵中HCl的质量分数(写出计算过程)。