题目内容
【题目】在一堂化学实验课上,老师为每组同学分别提供了一瓶未知溶质质量分数的氢氧化钠溶液,让他们用已知溶质质量分数为7.3%的稀盐酸来测定该氢氧化钠溶液的溶质质量分数。以下是几组同学的设想及做法:
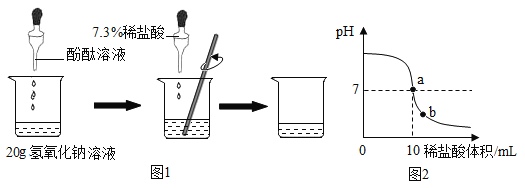
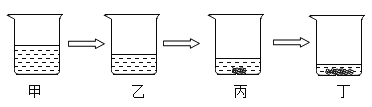
(1)甲组同学的实验如图1所示:在烧杯中加入20g该氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入7.3%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止,共用去稀盐酸10g,则甲组同学计算出这瓶氢氧化钠溶液溶质质量分数为4%,请回答:使用滴管慢慢滴入稀盐酸,并不断搅拌目的是____。
(2)乙组同学的设想是:在烧杯中加入一定质量的该氢氧化钠溶液,用滴管慢慢滴入7.3%的稀盐酸,并不断搅拌,在此过程中通过用pH试纸多次测定溶液pH的办法,来达到相同的实验目的.
①下列使用pH试纸的方法正确的是____(填字母).
A 将pH试纸剪成几段节约使用
B 将pH试纸浸入待测液中,与标准比色卡对照,测出pH为13
C 将pH试纸放在表面皿上,用玻璃棒蘸取待测液滴在pH试纸上与标准比色卡对照, 测出pH值为9.5
D 将pH试纸放在白色点滴板上,用玻璃棒蘸取待测液滴在pH试纸上与标准比色卡对照,测出pH值为7
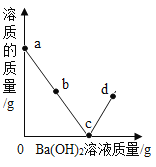
②由于用pH试纸多次测定较繁琐,在老师指导下,乙组同学取了20g该氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象.请回答:图2中a点表示的含义是____;b点溶液中含有大量的阳离子有____(填离子符号);
③乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数除了用到已有数据外,你认为还需要补充的数据是____。
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生.这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质,若要除去溶液中变质生成的杂质,可加入适量的____(填化学式)溶液后,再过滤。
【答案】使氢氧化钠和盐酸充分接触,充分反应 AD 氢氧化钠和稀盐酸恰好完全反应,恰好中和 Na+和H+ 稀盐酸的密度 Ca(OH)2
【解析】
(1)不断搅拌目的是使氢氧化钠和盐酸充分接触,故填:使氢氧化钠和盐酸充分接触,充分反应;
(2)①A、为节约pH试纸,将pH试纸剪成几段节约使用,A项正确;
B、pH试纸不能浸入待测液中,会污染待测液,B错误;
C、pH试纸与标准比色卡对照测得的pH值,都是整数,不可能出现小数,C选项错误;
D、将pH试纸放在白色点滴板上,用玻璃棒蘸取待测液滴在pH试纸上与标准比色卡对照,测出pH值为7,此时说明氢氧化钠和盐酸恰好完全反应,选项正确;
故选:AD
②a点pH=7,表示氢氧化钠和稀盐酸恰好完全反应,恰好中和,b点pH<7表示酸过量,此时溶液溶质为NaCl和HCl,溶液中含有的阳离子是Na+和H+;故填:氢氧化钠和稀盐酸恰好完全反应,恰好中和;Na+和H+;
③要求氢氧化钠溶液的溶质的质量分数,须知盐酸的质量,由图像可看出滴加的稀盐酸的体积,还需要的数据是稀盐酸的密度,故填:稀盐酸的密度;
(3)氢氧化钠变质的原因是与空气中的二氧化碳反应,生成了碳酸钠,滴加稀盐酸时发生反应生成了二氧化碳气体,因此有少量气泡产生,由于碳酸钠能与氢氧化钙(氢氧化钡)反应生成了氢氧化钠和碳酸钙(碳酸钡)沉淀,既除去了杂质碳酸钠,又没有引入新的杂质,故可用氢氧化钙(氢氧化钡)除去杂质。故填:Ca(OH)2

【题目】“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
甲 | 乙 | 丙 | |
烧杯+稀盐酸质量 | 139g | 129g | 129g |
加入黄铜样品质量 | 20g | 24g | 20g |
充分反应后,烧杯+剩余物质质量 | 158.8g | 152.8g | 148.8g |
发生的反应化学方程式:Zn+2HCl=ZnCl2+H2↑,请回答下列问题:
(1)同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是____________。
(2)所用的稀盐酸的溶质质量分数。____________