题目内容
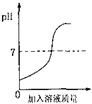 盐酸和氢氧化钠溶液进行中和反应的过程中,pH的变化曲线如图所示:
盐酸和氢氧化钠溶液进行中和反应的过程中,pH的变化曲线如图所示:(1)要得到此变化曲线,所进行的操作是
②
②
(填序号).①将稀盐酸滴加到氢氧化钠溶液中
②将氢氧化钠溶液滴加到稀盐酸中
(2)该反应的化学方程式为
NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.分析:(1)显酸性的溶液的pH小于7,显碱性溶液的pH大于7,可以据此解答.
(2)氢氧化钠溶液和盐酸反应能生成氯化钠和水.可以据此解答.
(2)氢氧化钠溶液和盐酸反应能生成氯化钠和水.可以据此解答.
解答:解:(1)由图中信息可知,反应开始时溶液呈酸性,所以可以判断进行的操作是将显碱性的溶液滴加到显酸性的溶液中,即将氢氧化钠溶液滴加到稀盐酸中.故填:②.
(2)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl═NaCl+H2O.
故答案为:(1)②.
(2)NaOH+HCl═NaCl+H2O.
(2)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl═NaCl+H2O.
故答案为:(1)②.
(2)NaOH+HCl═NaCl+H2O.
点评:本题主要考查中和反应和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容.要把12 g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g.

稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因 .
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
(4)若73 g质量分数为10%的盐酸与130g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容.要把12 g这种浓硫酸稀释为20%的硫酸,需要水的质量为

稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的Ba(NO3)2溶液,充分反应后过滤 | 有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)熟石灰是一种重要的碱,在工农生产和日常生活中都有十分广泛的应用.工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰.请你写出有关反应的化学方程式.
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
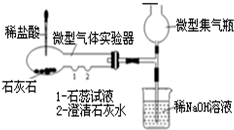 图是二氧化碳的制取和性质实验的微型一体化装置图,该装置的气密性良好.
图是二氧化碳的制取和性质实验的微型一体化装置图,该装置的气密性良好.