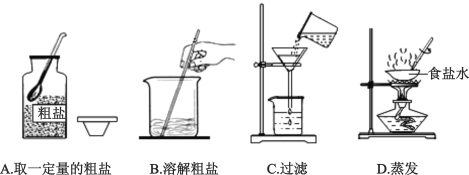
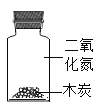
��Ŀ����
����Ŀ��ijѧϰС���ͬѧ����ѧϰ���ᡢ���ε�������ʺ���������ʵ��,��������һ��̽��:

��ͬѧʵ��ʱ������Ӧ�Ļ�ѧ����ʽΪ__________��
��ͬѧ�۲쵽��ʵ������Ϊ____________��
ʵ�������,�ס���ͬѧ���Թ�����Һ����ͬһ�ձ���,���ֲ�����ɫ�������ɴ˿�֪��ͬѧʵ��������Һ�к��е�������_________���ѧʽ����
[�������]�ձ�����Һ�к�����Щ������?
ͬѧ�ǽ��ձ��й�Һ��������,ȡ��Һ����,�����м��������̼������Һ,����������
[���������]��ͬѧ:Na+��Cl-
��ͬѧ:Na+��Cl-��OH-
��ͬѧ:Na+��Cl-��SO42-��Ba2+
[�����뽻��]���һ����Ϊ___________ͬѧ�IJ����Ǵ���ġ�������________��
[���̽��]��ͬѧΪ����֤�Լ��IJ��룬ȡ�ձ�����Һ������������ɫ��̪��Һ,û�й۲쵽����ʵ������,������Ϊ�Լ��IJ�����ȷ����Ҷ���Ϊ��ͬѧ��ʵ�����_______ ��������ȷ����������ȷ������ͬѧ��ͨ��ʵ������ȷ������Һ�е����ӳɷ֡�
[��˼���ջ�]������̽�����֪,����Һ�д������ӽ϶�ʱ�������ȼ����Լ�,����_______�ų�һЩ���롣���������ֻʣ�������ʱ,�����ʵ����Լ�,֤��______���ɡ�
���𰸡�![]() ����ɫ����Һ�в�����ɫ���� NaCl ��BaCl2 �� ��������̼������ӻ����̼�ᱵ��ɫ���������������̼������Һ������֤��û�б����ӣ����������������������Һ�в��ܹ��棬�ʴ��� ����ȷ ʵ������ ���ܴ��ڵ����ӣ��Ƿ���ڣ�
����ɫ����Һ�в�����ɫ���� NaCl ��BaCl2 �� ��������̼������ӻ����̼�ᱵ��ɫ���������������̼������Һ������֤��û�б����ӣ����������������������Һ�в��ܹ��棬�ʴ��� ����ȷ ʵ������ ���ܴ��ڵ����ӣ��Ƿ���ڣ�
��������
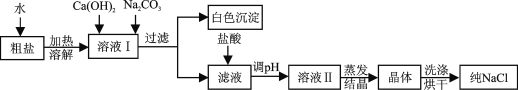
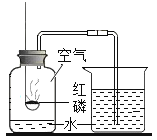
��ͬѧʵ��ʱ��ϡ������������Ʒ�Ӧ���������ƺ�ˮ��������Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��ͬѧʵ���ң������ķ�Ӧ���Ȼ�����̼���Ʒ�Ӧ����̼�ᱵ�������Ȼ��ƣ��ܹ۲쵽��ʵ������Ϊ����ɫ����Һ�в�����ɫ������
ʵ�������,�ס���ͬѧ���Թ�����Һ����ͬһ�ձ���,���ֲ�����ɫ���������ڼ��Թ���������һ�����ڣ���ô���Թ���һ�����Ȼ��������Ȼ���Ϊ������һ�����ڣ��ɴ˿�֪��ͬѧʵ��������Һ�к��е������Ƿ�Ӧ���ɵ��Ȼ��ƺ������Ȼ�����
[�����뽻��]���һ����Ϊ��ͬѧ�IJ����Ǵ���ġ������DZ�������̼������ӻ����̼�ᱵ��ɫ���������������̼������Һ������֤��û�б����ӣ����������������������Һ�в��ܹ��棬�ʴ���
[���̽��]��Ҷ���Ϊ��ͬѧ��ʵ����۲���ȷ���������ڷ�̪����ɫֻ��֤��̼����ȫ����Ӧ��ȫ��������֪�������Ƿ������
[��˼���ջ�]������̽�����֪������Һ�д������ӽ϶�ʱ�������ȼ����Լ�,����ʵ�������ų�һЩ���롣���������ֻʣ�������ʱ,�����ʵ����Լ�,֤�����ܴ��ڵ����Ӽ��ɡ�

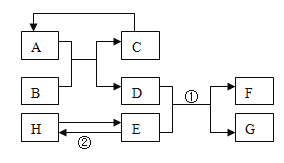
����Ŀ�����ࡢ�����ѧϰ��ѧ���õķ�����������Щ����������ѧ��ѧϰ��ѧ֪ʶ��
��1�����л�ѧ������ʵ�飬������ʵ����ҪĿ�Ŀɽ�ʵ���Ϊ��̽�����ʷ�����ѧ��Ӧǰ��������ϵ��̽�����ʵ����ʣ�̽�����ʵĺ����ȡ��ݴ�Ӧ������ʵ���е�D��_______���A����B����C������Ϊһ�࣬������_____��
|
|
|
|
A | B | C | D |
��2���ٵ�����Ϊ 10 �����Ӻܶ࣬���а���������������������һЩ���ӡ��뽫���ʵĻ�ѧ��������հ�HF��H2O��_____��CH4��Ne��
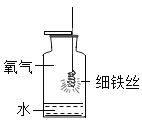
�ڲ������ϵ�֪Mg��Mn��Fe��Cu���ֽ������˳���ǣ�����ǿ������������ʵ����֤������ۣ�����ͨ�����������û���Ӧ��֤�� ����������Ӧ�Ļ�ѧ����ʽΪ:A.![]() ��B.
��B.![]() ���������������Ӧ�Ļ�ѧ����ʽ����д��ȱ�ٵ�һ����Ӧ�Ļ�ѧ����ʽΪ_____��
���������������Ӧ�Ļ�ѧ����ʽ����д��ȱ�ٵ�һ����Ӧ�Ļ�ѧ����ʽΪ_____��