题目内容
【题目】将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)与足量稀硫酸反应,得到0.48gH2 (FexC与稀硫酸反应不产生H2)。若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO2.试通过计算确定:
(1)此粗还原铁粉中单质铁的质量_____
(2)此粗还原铁粉中杂质FexC的化学式。_____
【答案】13.44g Fe2C
【解析】
若将14.06g还原铁粉(含少量FexC)在氧气流中加热,得到0.22gCO2,碳元素的质量=0.22g×![]() =0.06g
=0.06g
(1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH2,设消耗铁的质量为x。
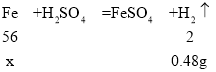
![]()
x=13.44g
FexC的质量=14.06g﹣13.44g=0.62g;
FexC的中铁元素的质量=0.62g﹣0.06g=0.56g
则:![]()
x=2
所以化学式为Fe2C

练习册系列答案
相关题目