题目内容
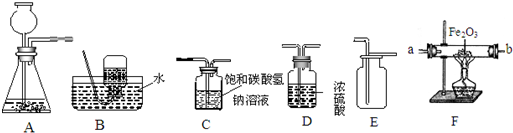
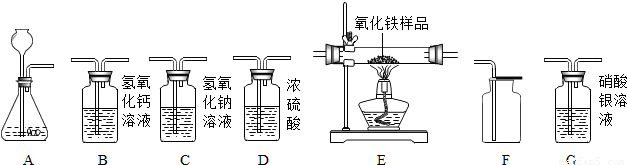
如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).
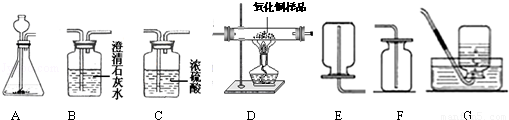
试根据题目要求,回答下列问题:
(1)若用铁粉和稀盐酸(盐酸具有挥发性)反应制取并收集干燥的氢气.
①制取并收集干燥的氢气所选仪器的连接顺序为 (填写仪器序号字母).
②制取氢气的反应方程式为 .
③进行实验前,首先要做的一步工作是 .
(2)小明同学欲用一氧化碳气体(含少量二氧化碳和水蒸气)测定10克不纯氧化铜样品的纯度(杂质不参与反应),并验证反应中气体生成物的性质.所选仪器的连接顺序为:B1→C→D→B2.
①写出装置B1中发生反应的化学方程式 .
②装置D中观察到的实验现象是 .
③假设实验结束后,测得B2装置的质量比反应前增加了4.4克,由此推算出装置D中固体的质量减少了 克.
④小明同学的设计方案有一明显的不足,这样操作可能造成的后果是 .
(1)①ABCE; ②Fe+2HCl═FeCl2+H2↑;③检查装置的气密性;
(2)①Ca(OH)2+CO2═CaCO3↓+H2O;②黑色固体变为红色固体; ③1.6;
④剩余的一氧化碳污染空气(答案合理即可)
【解析】
试题分析:(1)①用铁粉和稀盐酸(盐酸具有挥发性)反应制取氢气用A装置,盐酸挥发氯化氢气体,混有的氯化氢气体用澄清的石灰水除去,干燥用浓硫酸,氢气密度比空气小,用向下排空气法收集,而气体从溶液中出来会带来水蒸气,所以要先除杂再干燥,然后收集,故制取并收集干燥的氢气所选仪器的连接顺序为ABCE。
②铁和稀盐酸反应生成氯化亚铁和氢气,方程式是Fe+2HCl═FeCl2+H2↑。
③实验前要检查装置的气密性,防止装置漏气。
(2)①装置B1中发生反应是二氧化碳与澄清石灰水的反应,二者反应生成碳酸钙沉淀和水,方程式是Ca(OH)2+CO2═CaCO3↓+H2O。
②一氧化碳具有还原性,可将黑色的氧化铜还原为红色的铜。
③根据②分析可知:装置D中固体减少的质量是氧化铜中氧元素的质量,B2装置放的是澄清的石灰水,可与一氧化碳和氧化铜反应生成的二氧化碳充分反应,故该装置增加的质量即是反应生成的二氧化碳的质量,设样品中氧化铜的质量为x
CuO+CO Cu+CO2
Cu+CO2
80 44
x 4.4g
 =
= x=8g
x=8g
氧化铜中氧元素的质量为:8g× ×100%=1.6g,则装置D中固体减少的质量是1.6g;
×100%=1.6g,则装置D中固体减少的质量是1.6g;
④小明未设计尾气处理装置,会使未参加反应的一氧化碳排放到空气中污染空气;
考点:本题考查常用气体的发生装置和收集装置与选取方法;一氧化碳的化学性质;氢气的制取和检验;书写化学方程式、文字表达式、电离方程式。

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案

 2Fe+3CO2)
2Fe+3CO2)