题目内容
【题目】水与人们的生活有着密切的关系。

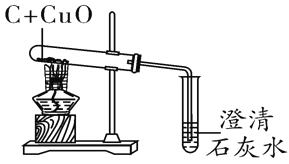
(1)为验证水的组成用如右图所示装置进行实验。
①写出该反应的化学方程式___________________。
②电解水的过程中,发生改变的微粒是_______(写名称)。
③下列物质溶于水后能导电的是______(填字母)。
A.蔗糖 B.氯化氢 C.氯化钠 D.氢氧化钙
(2)配制200g质量分数为5%的氢氧化钠溶液,需要需要水____mL。配制时用到玻璃仪器有________、烧杯、玻璃棒和胶头滴管。(水的密度近似看作1g/cm3)
(3)用配得氢氧化钠溶液与某硫酸溶液反应,下图是利用数字化传感器得到的溶液pH变化图像。
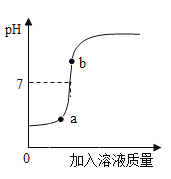
①根据图中曲线,判断进行的操作是______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②从微观角度分析,该反应实质为___________ 。
③b点对应的溶液中的溶质为____________写化学式)。
④若80g 5%的氢氧化钠溶液能恰好中和50g硫酸溶液,试计算该硫酸溶液的溶质质量分数_________。
【答案】2H2O![]() 2H2↑+O2↑ 水分子 BCD 190 量筒 B 氢离子和氢氧根离子结合成水分子 Na2SO4 、NaOH 9.8%
2H2↑+O2↑ 水分子 BCD 190 量筒 B 氢离子和氢氧根离子结合成水分子 Na2SO4 、NaOH 9.8%
【解析】
(1)①电解水是水在通电的条件下生成氢气和和氧气,对应的化学方程式2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
②分子构成的物质,分子是保持其物质化学性质的最小微粒;所以电解水的过程中,发生改变的微粒是水分子;
③物质溶于水后能导电是因为能形成离子;
A、蔗糖溶于水,依然是蔗糖分子,不能形成离子,不导电;
B、氯化氢溶于水,形成氢离子和铝离子,能够导电;
C、氯化钠溶于水,形成钠离子和氯离子,能够导电;
D、氢氧化钙溶于水,形成钙离子和氢氧根离子,能够导电;
(2)溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量,所以配制200g质量分数为5%的氢氧化钠溶液,需要氢氧化钠的质量为:200g×5%=10g,需要水的质量为200g-10g=190g,合190mL,配制时用到玻璃仪器有量筒、烧杯、玻璃棒和胶头滴管;
(3)①由溶液pH的变化可知,起始时溶液pH小于7,加入溶液后pH逐渐变大,进行的操作应是将氢氧化钠溶液逐滴滴加到硫酸溶液中;
②从微观角度微粒的变化可知,该反应实质为氢离子和氢氧根离子结合成水分子;
③由曲线可知,b点对应的溶液的pH大于7,说明加入的氢氧化钠是过量的,溶质为:Na2SO4、NaOH;
④设硫酸溶液中溶质的质量为x,则:
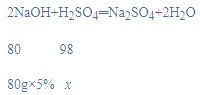
![]()
x=4.9g,
该硫酸溶液的溶质质量分数是:![]() ×100%=9.8%。
×100%=9.8%。

 53随堂测系列答案
53随堂测系列答案