题目内容
为了测定人呼出气体中CO2的体积含量,化学小组的同学设计如下实验:①收集5L某同学呼出的气体样品;
②在气体样品中加入过量的澄清石灰水,振荡,充分反应.
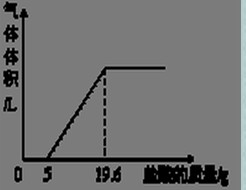
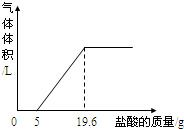
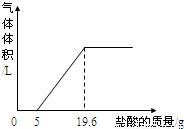
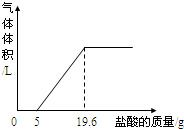
③把反应后的溶液转移到烧杯中,滴入5%的稀盐酸,到不产生气泡为止.产生气体体积与加入盐酸质量的关系如图所示.
请回答问题:
(1)加入5g盐酸前没有产生气体的原因?
(用化学方程式表示)
(2)加入盐酸产生CO2的质量是多少克?(溶于水的CO2忽略不计)
(3)计算该气体样品与所含CO2的体积比.(常温下CO2的密度为1.96g/L)
【答案】分析:(1)向氢氧化钙溶液与碳酸钙的混合液中加入稀盐酸,稀盐酸会在反应完溶液中的氢氧化钙后与碳酸钙发生反应放出二氧化碳;
(2)由与碳酸钙发生反应的(19.6g-5g=14.6g)稀盐酸中HCl的质量,根据反应的化学方程式,计算放出二氧化碳的质量;
(3)与碳酸钙反应放出气体的质量即澄清石灰水吸收的该同学呼出5L气体中二氧化碳,利用二氧化碳的质量与密度计算反应放出二氧化碳气体的体积,该体积与呼出气体体积比即该气体样品与所含CO2的体积比.
解答:解:(1)过量的澄清石灰水中剩余氢氧化钙与盐酸发生反应,生成氯化钙和水;待氢氧化钙完全反应后,盐酸与碳酸钙开始发生反应放出二氧化碳,因此,加入5g盐酸后才有气体产生;
故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;
(2)设产生CO2的质量为x
CaCO3+2HCl═CaCl2+2H2O+CO2↑
73 44
14.6g×5% x
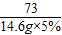 =
=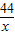
x=0.44g
(3)CO2的体积=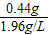 =0.22L
=0.22L
∴气体样品与所含CO2的体积比=5L:0.22L=500:22=250:11
答:(2)加入盐酸产生CO2的质量是0.44g;(3)计算该气体样品与所含CO2的体积比为250:11.
点评:曲线的起点即所加盐酸与氢氧化钙完全反应开始与碳酸钙发生反应,曲线的折点即所加盐酸把碳酸钙完成反应.
(2)由与碳酸钙发生反应的(19.6g-5g=14.6g)稀盐酸中HCl的质量,根据反应的化学方程式,计算放出二氧化碳的质量;
(3)与碳酸钙反应放出气体的质量即澄清石灰水吸收的该同学呼出5L气体中二氧化碳,利用二氧化碳的质量与密度计算反应放出二氧化碳气体的体积,该体积与呼出气体体积比即该气体样品与所含CO2的体积比.
解答:解:(1)过量的澄清石灰水中剩余氢氧化钙与盐酸发生反应,生成氯化钙和水;待氢氧化钙完全反应后,盐酸与碳酸钙开始发生反应放出二氧化碳,因此,加入5g盐酸后才有气体产生;
故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;
(2)设产生CO2的质量为x
CaCO3+2HCl═CaCl2+2H2O+CO2↑
73 44
14.6g×5% x
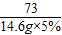 =
=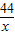
x=0.44g
(3)CO2的体积=
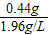 =0.22L
=0.22L∴气体样品与所含CO2的体积比=5L:0.22L=500:22=250:11
答:(2)加入盐酸产生CO2的质量是0.44g;(3)计算该气体样品与所含CO2的体积比为250:11.
点评:曲线的起点即所加盐酸与氢氧化钙完全反应开始与碳酸钙发生反应,曲线的折点即所加盐酸把碳酸钙完成反应.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
 为了测定人呼出气体中CO2的体积含量,化学小组的同学设计如下实验:
为了测定人呼出气体中CO2的体积含量,化学小组的同学设计如下实验: