题目内容
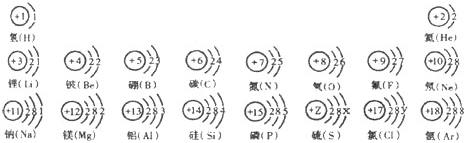
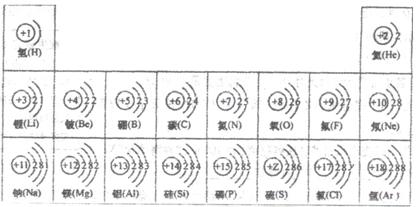
试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题: 氢(H) 氢(H) | 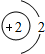 氦(He) 氦(He) | ||||||
 锂(Li) 锂(Li) |  铍(Be) 铍(Be) |  硼(B) 硼(B) |  碳(C) 碳(C) |  氮(N) 氮(N) |  氧(O) 氧(O) | 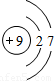 氟(F) 氟(F) |  氖(Ne) 氖(Ne) |
 钠(Na) |  镁(Mg) |  铝(Al) | 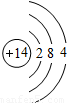 硅(Si) 硅(Si) |  磷(P) 磷(P) |  硫(S) 硫(S) |  氯(Cl) 氯(Cl) |  氩(Ar) 氩(Ar) |
①从原子结构示意图分析,11~18号元素排在一行的依据是 ;
②在此周期中,从左到右,原子结构变化情况是 ;
③在此周期中,从左到右,元素原子得失电子的变化情况是 ;
④在此周期中,从左到右,元素种类的变化情况是 .
(2)上图中硫元素的核电荷数Z= ;氯元素的最外层电子数Y= (填数值).
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是 .
它的核外电子排布与 元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个: .
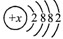
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图
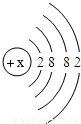 所示,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 .该元素在上表中位于 (选A、B、C)处.
所示,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 .该元素在上表中位于 (选A、B、C)处.(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的电子数 (填相同或不同),化学性质 .
【答案】分析:(1)①元素的周期数与原子的核外电子层数相同,在元素周期中每一周期最外层电子数遵守从1至8的循环规律;②在此周期中,从左到右,原子最外层电子数依次增多;③在此周期中,从左到右,由易失电子过渡到容易得电子;④在此周期中,从左到右,由金属元素过渡到非金属元素;
(2)根据元素周期律:在元素周期表中,同一周期元素从左到右原子序数的逐渐递增,进行解答;根据在原子中,原子序数=质子数=核外电子数,进行解答;
根据元素周期律:同一纵行,原子最外层电子数相同,最外层电子数相同的元素化学性质相似,进行解答;
(3)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,及离子示意图找出相同的结构,进行解答;
(4)根据元素周期律的相关知识来回答;
(5)利用原子结构示意图中电子数等于质子数,以及最外层电子数的特点进行分析判断;
(6)根据原子序数=核外电子数来判断两种原子的电子数关系,根据两种原子的电子层结构判断二者的化学性质.
解答:解:(1)从原子结构示意图分析,11~18号元素排在一行,周期数和核外电子层数相同.在同一周期内原子的核电荷数和最外层电子数依次递增;最外层电子数小于4时,易失去电子.最外层电子数大于4时易得到电子;在元素周期表中,前面的是金属元素,后面是非金属元素;
(2)根据元素周期律:在元素周期表中,同一周期元素从左到右原子序数的逐渐递增,硫元素的核电荷数介于15与17 之间;所以硫元素的核电荷数z=16;根据在原子中,原子序数=质子数=核外电子数,可得 17=2+8+y,则y=7;
(3)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,所以核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号为:
Mg2+,它的核外电子排布与Ne元素的原子核外电子排布相同;
(4)根据元素周期律:同一行中,从左到右元素的核电荷数、最外层电子数依次增加;
(5)钙的质子数为20,属于金属元素.因钙原子的最外层电子数为2,所以在形成化合物时,失去最外层电子,化合价为+2价;
(6)根据原子序数=核外电子数知:3He、4He两种原子的电子数相同,同位素化学性质相似.
故答案为:(1)①原子核外都有三个电子层②原子最外层电子数依次增多③由易失电子过渡到容易得电子④由金属元素过渡到非金属元素;(2)16、7;(3)Mg2+、Ne;(4)同一行中,从左到右元素的最外层电子数依次增加;(5)20、金属、+2、B;(6)相同、相似.
点评:本题主要考查了原子的结构示意图的意义,培养学生分析信息寻找规律以及解决问题的能力.
(2)根据元素周期律:在元素周期表中,同一周期元素从左到右原子序数的逐渐递增,进行解答;根据在原子中,原子序数=质子数=核外电子数,进行解答;
根据元素周期律:同一纵行,原子最外层电子数相同,最外层电子数相同的元素化学性质相似,进行解答;
(3)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,及离子示意图找出相同的结构,进行解答;
(4)根据元素周期律的相关知识来回答;
(5)利用原子结构示意图中电子数等于质子数,以及最外层电子数的特点进行分析判断;
(6)根据原子序数=核外电子数来判断两种原子的电子数关系,根据两种原子的电子层结构判断二者的化学性质.
解答:解:(1)从原子结构示意图分析,11~18号元素排在一行,周期数和核外电子层数相同.在同一周期内原子的核电荷数和最外层电子数依次递增;最外层电子数小于4时,易失去电子.最外层电子数大于4时易得到电子;在元素周期表中,前面的是金属元素,后面是非金属元素;
(2)根据元素周期律:在元素周期表中,同一周期元素从左到右原子序数的逐渐递增,硫元素的核电荷数介于15与17 之间;所以硫元素的核电荷数z=16;根据在原子中,原子序数=质子数=核外电子数,可得 17=2+8+y,则y=7;
(3)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,所以核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号为:
Mg2+,它的核外电子排布与Ne元素的原子核外电子排布相同;
(4)根据元素周期律:同一行中,从左到右元素的核电荷数、最外层电子数依次增加;
(5)钙的质子数为20,属于金属元素.因钙原子的最外层电子数为2,所以在形成化合物时,失去最外层电子,化合价为+2价;
(6)根据原子序数=核外电子数知:3He、4He两种原子的电子数相同,同位素化学性质相似.
故答案为:(1)①原子核外都有三个电子层②原子最外层电子数依次增多③由易失电子过渡到容易得电子④由金属元素过渡到非金属元素;(2)16、7;(3)Mg2+、Ne;(4)同一行中,从左到右元素的最外层电子数依次增加;(5)20、金属、+2、B;(6)相同、相似.
点评:本题主要考查了原子的结构示意图的意义,培养学生分析信息寻找规律以及解决问题的能力.

练习册系列答案
相关题目



 所示,则该元素的原子序数为
所示,则该元素的原子序数为