题目内容
【题目】已知K2Cr2O7、KCl、NaCl、Na2Cr2O7四种物质的溶解度曲线甲、乙、两、丁如图所示,但不知具体对应是哪条曲线。
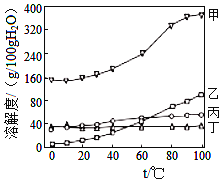
(Ⅰ)80℃时100g四种饱和溶液中,溶质质量分数小的是NaCl溶液。
(Ⅱ)温度在40~80℃时,K2Cr2O7分别与KCl、NaCl可以配成相同温度下相同浓度的饱和溶液。
(1)NaCl的溶解度曲线是_______(填“甲”“乙”“丙或“丁”),曲线丙对应的物质是______________。
(2)40℃时,50g水中加入70 g Na2Cr2O7形成的溶液是___________(填“饱和”成“不饱和“)溶液。
(3)90℃时K2Cr2O7、KC1的饱和溶液降温至20℃,K2Cr2O7溶质质量分数_______KCl溶质质量分数(填“>”“<”或“=”)。
(4)90℃时,等质量四种物质分别配成饱和溶液所需要水质量最少的是______________。
【答案】丁 KCl 不饱和 < Na2Cr2O7
【解析】
(1)80℃时,100g的四种饱和溶液中,溶质质量分数最小的是NaCl溶液,则80℃时,NaCl的溶解度最小,则丁是NaCl。在40℃-80℃时,K2Cr2O7分别于与KCl、NaCl可以配成相同温度下相同浓度的饱和溶液,因此曲线乙对应的物质是K2Cr2O7,曲线甲对应的物质是Na2Cr2O7,曲线丙是KCl。故答案为:丁、KCl;
(2)40℃时,Na2Cr2O7的溶解度大于160g,小于240g。则在50g水中,最多能溶解的Na2Cr2O7的质量约为80g-120g,则在50g水中加入70gNa2Cr2O7形成的溶液是该温度下的不饱和溶液。故答案为:不饱和;
(3)90℃时,K2Cr2O7、KCl的饱和溶液降温至20℃,K2Cr2O7溶质质量分数小于KCl的溶质质量分数,因为降温后,KCl的溶解度大于K2Cr2O7的溶解度。故答案为:<;
(4)90℃时,等质量的四种物质分别配制成饱和溶液,所需要水的质量最少的是Na2Cr2O7,因为在该温度下,Na2Cr2O7的溶解度最大。故答案为:Na2Cr2O7。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】鸡蛋壳中含有碳酸钙,为了测定蛋壳中碳酸钙的质量分数,某兴趣小组取鸡蛋壳和足量稀盐酸在烧杯中反应(假设蛋壳中杂质不与稀盐酸反应,反应产生气体全部放出),有关实验数据如下表:
反应前反应后 | |||
实验数据 | 鸡蛋壳质量 | 烧杯和稀盐酸质量 | 烧杯和其中混合物的质量 |
12g | 120g | 127.6 g |
试计算:
(1)生成二氧化碳的质量是多少g。
(2)计算鸡蛋壳中碳酸钙的质量分数(写出计算过程,计算结果保留一位小数)。