题目内容
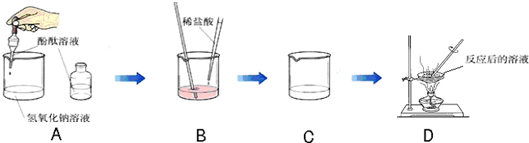
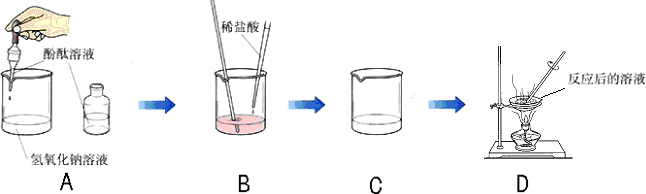
某化学学习小组的同学为了探究氢氧化钠溶液与稀盐酸是否恰好完全反应,做了如下图所示的实验:
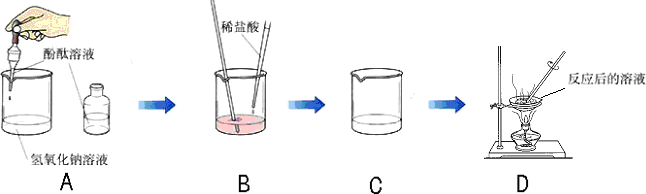
(1)实验中酚酞溶液的作用是______.
(2)D中溶液蒸发后留下的固体是(写化学式)______,能说明此结论的实验现象是______.
(3)如果经测定,蒸发得到的固体中含有CaCl2(其溶液为中性),那么原NaOH溶液(假定盐酸纯净)中可能混有的杂质是(任写一种杂质的化学式)______.
同学们为了尝试测定上述食盐(含杂质CaCl2)的质量分数并提纯,做了如下实验.请根据实验回答有关问题:
①准确称取10g固体样品,溶于适量蒸馏水中,再加入过量的下列某溶液,反应后过滤,得沉淀物1g.加入的某溶液是______(填编号).
A.NaOH B.K2CO3 C.Na2CO3 D.AgNO3 E.HCl(稀)
其反应的化学方程式是______
②往滤液中加入过量的稀盐酸,加入过量稀盐酸的原因是______.
③将加入稀盐酸后的滤液放在蒸发皿里加热蒸发.加热过程中,要用玻璃棒不断搅拌,其作用是______.
④计算样品中NaCl的质量分数为______.
解:(1)氢氧化钠与盐酸反应没有明显现象,因此加入酚酞可通过指示剂颜色的变化指示氢氧化钠与盐酸反应进行的程度,故答案为:指示氢氧化钠与盐酸何时恰好完全反应;
(2)氢氧化钠与盐酸反应生成氯化钠和水,D中溶液蒸发后留下的固体是 NaCl,B中的溶液由红色变成无色能说明此结论.
(3)若蒸发得到的固体中含有CaCl2(其溶液为中性),则原NaOH溶液(假定盐酸纯净)中可能混有的杂质是
Ca(OH)2(或CaCl2).含氢氧化钙时可与盐酸反应生成氯化钙.
①加入的某溶液需将溶液中的钙离子全部转化为沉淀,故选C其反应的化学方程式是 CaCl2+Na2CO3═CaCO3↓+2 NaCl
②往滤液中加入过量的稀盐酸,加入过量稀盐酸是为了 将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
③加热蒸发过程中,要用玻璃棒不断搅拌,防止液体受热不均匀,液滴飞溅.
④设氯化钙的质量为x,
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100
x 1g
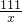 =
=
x=1.11g
所以氯化钠的质量分数为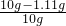 ×100%=88.9%
×100%=88.9%
故答案为:
(1)指示氢氧化钠与盐酸何时恰好完全反应;
(2)NaCl,B中的溶液由红色变成无色.
(3)Ca(OH)2(或CaCl2).
①C,CaCl2+Na2CO3═CaCO3↓+2 NaCl
②将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
③使液体受热均匀,防止液滴飞溅
④88.9%
分析:(1)根据酚酞指示剂的变色情况解答
(2)根据中和反应的产物解答
(3)根据生成物可推断反应物,除杂质常用的方法是化气法和沉淀法.根据生成沉淀 的质量可求出氯化钙质量,进而求了氯化钠的质量分数.
点评:可溶性碱与酸反应无明显现象,需借助指示剂,除杂质时加入的试剂只能与杂质反应.
(2)氢氧化钠与盐酸反应生成氯化钠和水,D中溶液蒸发后留下的固体是 NaCl,B中的溶液由红色变成无色能说明此结论.
(3)若蒸发得到的固体中含有CaCl2(其溶液为中性),则原NaOH溶液(假定盐酸纯净)中可能混有的杂质是
Ca(OH)2(或CaCl2).含氢氧化钙时可与盐酸反应生成氯化钙.
①加入的某溶液需将溶液中的钙离子全部转化为沉淀,故选C其反应的化学方程式是 CaCl2+Na2CO3═CaCO3↓+2 NaCl
②往滤液中加入过量的稀盐酸,加入过量稀盐酸是为了 将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
③加热蒸发过程中,要用玻璃棒不断搅拌,防止液体受热不均匀,液滴飞溅.
④设氯化钙的质量为x,
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100
x 1g
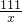 =
=
x=1.11g
所以氯化钠的质量分数为
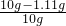 ×100%=88.9%
×100%=88.9%故答案为:
(1)指示氢氧化钠与盐酸何时恰好完全反应;
(2)NaCl,B中的溶液由红色变成无色.
(3)Ca(OH)2(或CaCl2).
①C,CaCl2+Na2CO3═CaCO3↓+2 NaCl
②将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
③使液体受热均匀,防止液滴飞溅
④88.9%
分析:(1)根据酚酞指示剂的变色情况解答
(2)根据中和反应的产物解答
(3)根据生成物可推断反应物,除杂质常用的方法是化气法和沉淀法.根据生成沉淀 的质量可求出氯化钙质量,进而求了氯化钠的质量分数.
点评:可溶性碱与酸反应无明显现象,需借助指示剂,除杂质时加入的试剂只能与杂质反应.

练习册系列答案
相关题目
 实验是化学的灵魂,是学好化学的重要环节.
实验是化学的灵魂,是学好化学的重要环节.