题目内容
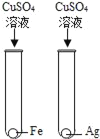
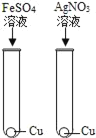
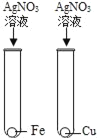
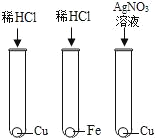
【题目】某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量)。下列判断不正确的是( )
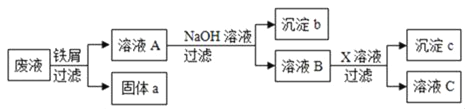
A. 固体a是混合物
B. 溶液B中的含有的盐是Ba(NO3)2和NaNO3
C. X可能是Na2CO3
D. 若回收到6.4g固体a,则加入的铁屑质量为5.6g
【答案】D
【解析】
由于铁的金属活动性大于铜,由题意可知,向废液中加入过量的铁屑,铁能与硝酸铜反应生成了铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成了氢氧化亚铁沉淀和硝酸钠,氢氧化亚铁在空气中已被氧化为氢氧化铁;为了除去钡离子,应加入硫酸钠、碳酸钠等。所以:
A、由上述分析可知,固体a是铜、铁,故A说法正确;
B、由上述分析可知,溶液B中含有的盐有Ba(NO3)2、NaNO3,故B说法正确;
C、由上述分析可知,X可能是Na2SO Na2CO3,故C说法正确;
D、由反应方程式可知铁置换出铜后的固体质量还要增加;则依据D选项可知:两固体的质量差为6.4g﹣5.6g=0.8g
设反应的铁的质量是x
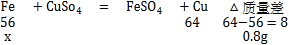
![]()
解得:x=5.6g
由题意知铁是过量的,所以5.6g不可能都反应,与题意矛盾,故D说法错误。
故选:D。

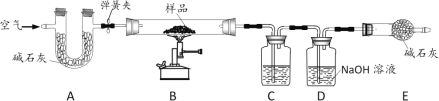
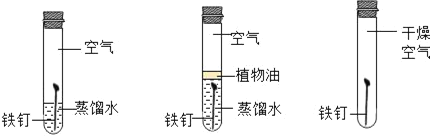
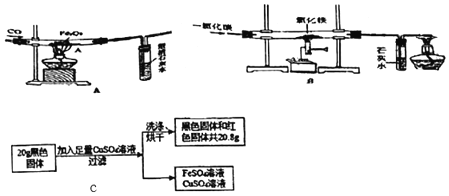
【题目】杨敏在实验室进行CO还原氧化铁的实验采用酒精灯加热(图A)与书本实验(图B)现象相同,发现在得到的黑色粉末中加稀盐酸,没有气泡产生,杨敏就图A实验中反应后得到的黑色粉末的成分进行了如下探究。
(查阅资料)①铁粉及铁的几种常见氧化物的颜色及部分性质。
物质 | 铁粉 | Fe2O3 | Fe3O4 | FeO |
颜色 | 黑色 | 红棕色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 能 | 不能 |
②实验室酒精灯的温度为400﹣500℃,酒精喷灯的加热温度在1000℃左右。
③当温度高于300℃以上,Fe2O3容易被还原成Fe3O4;当温度高于600℃以上,Fe3O4容易被还原FeO;当温度高于700℃以上,FeO容易被还原成Fe;
(提出问题)图A实验得到黑色粉末的成分是什么?
(提出猜想)黑色粉末的成分是:①FeO、Fe3O4②FeO③Fe3O4;④FeO、Fe3O4、Fe2O3。
(分析与评价)猜想_____错误,理由是_____。
(1)装置A有一处明显错误,该错误是_____。
(2)请写出澄清石灰水中发生的反应的化学方程式_____。
(3)由对比实验可知,还原氧化铁的实验产物与_____有关。
(实验设计)将图A实验得到黑色粉末倒在一表面皿中,用磁铁接触黑色粉末,出现_____现象,说明猜想②正确。
(4)实验B最后得到的黑色固体可能是Fe和Fe3O4,中的一种或两种。小海设计如下实验探究其成分,请帮助他完成该探究过程。
(探究过程)①定性研究:取少量的图B实验得到的黑色粉末于一试管中,加入适量的硫酸铜溶液,充分振荡,出现_____现象,证明黑色固体中有铁。
②定量研究:取B实验得到的黑色固体20g,设计如图C实验:试推测黑色固体的成分是_____。
③有同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)_____(填“行”或“不行”)理由是_____。
【题目】马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
加入稀盐酸的质量/g | 生成气体的总质量/g | |
第1次 | 20 | 1.1 |
第2次 | 20 | 2.2 |
第3次 | 20 | m |
第4次 | 20 | 4.4 |
第5次 | 20 | 4.4 |
(1)m的值为_________g
(2)12g石灰石样品中碳酸钙的质量等于_________g
(3)反应完全后最终溶液中氯化钙的质量分数为_______?(写出计算过程,计算结果精确至0.1)