题目内容
【题目】广泛应用于火箭、导弹和飞机制造业的金属镁,是利用从海水中提取的镁盐制取的,其流程如下图:
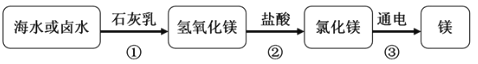
(1)海水提取MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程的目的是_______。
(2)把15. 3gMg(OH)2和MgCl2的混合物加入盛有水的烧杯中,充分溶解后,向烧杯中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如下图所示。试回答下列问题:

①当滴入上述稀盐酸至图中A点时,烧杯中溶液里的溶质为__________(写化学式)。
②当滴入7.3%的稀盐酸100g时(即图中B点),恰好完全反应,试通过计算,求此温度时所得不饱和溶液中溶质的质量________。(计算结果精确至0.1g )
【答案】富集、提纯镁 MgCl2 19.0g.
【解析】
(1)因为海水中MgCl2的含量较低,还含有其他可溶性杂质,所以海水提取MgCl2时,必须经历 “MgCl2→Mg(OH)2→MgCl2”的转化过程。在MgCl2→Mg(OH)2过程中,MgCl2和Ca(OH)2反应生成Mg(OH)2沉淀,然后将Mg(OH)2分离出来,再将Mg(OH)2和盐酸反应,重新获得MgCl2,这时MgCl2中已无其他杂质,电解出来的镁纯度就较高。这样做达到了富集和提纯镁的目的。
(2)①因为Mg(OH)2难溶于水,MgCl2易溶于水,起点溶液中溶质是MgCl2,随着稀盐酸的加入,Mg(OH)2和稀盐酸反应生成MgCl2和水,溶液中溶质仍然是MgCl2,从图中看出,滴入稀盐酸至B点,Mg(OH)2和稀盐酸完全反应,所以当滴入稀盐酸至图中A点时,烧杯中溶液里的溶质是:MgCl2。
②当滴入7.3%的稀盐酸100g时(即图中B点),Mg(OH)2和稀盐酸恰好完全反应,所得溶液中溶质是MgCl2,但其质量应为原混合物中的MgCl2和反应中生成的MgCl2之和。
解:设15. 3gMg(OH)2和MgCl2的混合物中Mg(OH)2的质量为x,反应生成的MgCl2质量为y。
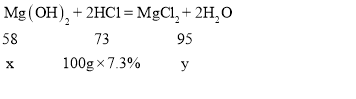
![]()
解得 x=5.8g
![]()
解得 y=9.5g
因为得到的是MgCl2的不饱和溶液,所以溶液中MgCl2的质量=15.3g-5.8g+9.5g=19.0g
答:此温度时所得不饱和溶液中溶质的质量是19.0g.

【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O43H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O43H2O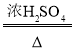 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
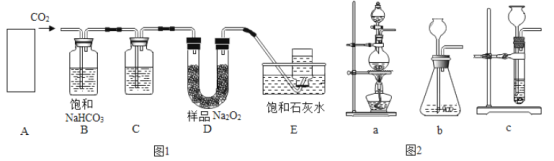
(问题讨论)用如图所示装置进行实验:
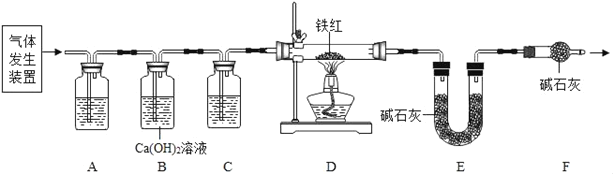
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_____(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是_____。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后_____。
(数据分析与计算)
(资料2)铁的常见氧化物中铁的质量分数
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(5)称取铁红样品10.0g用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是_____。
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_____。(计算结果精确到0.1%)
(实验评价)
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会_____(填“偏小”、“不变”或“偏大”)。