题目内容
【题目】“侯氏制碱法”主要是利用NaCl、![]() 、
、![]() 制备
制备![]() 同时得到副产品
同时得到副产品![]() ,下表是
,下表是![]() 的一组溶解度数据:
的一组溶解度数据:
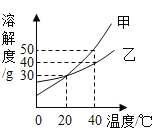
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
(1)“碱”——![]() 属于______(填“酸”、“碱”或“盐”),俗称_____;
属于______(填“酸”、“碱”或“盐”),俗称_____;![]() 中含有______(填元素符号),在农业生产中可用作化肥。
中含有______(填元素符号),在农业生产中可用作化肥。
(2)向20℃100g水中加入![]() 固体或升高温度,得到下图相应的溶液A—D
固体或升高温度,得到下图相应的溶液A—D
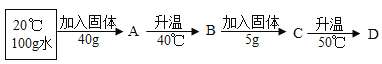
溶液C是______溶液(填“饱和”或“不饱和”)。
(![]() 晶体的大烧杯中,并向大烧杯中加水,小烧杯中出现的现象是______,原因是_____。
晶体的大烧杯中,并向大烧杯中加水,小烧杯中出现的现象是______,原因是_____。
(4)检验“侯氏制碱法”制得的![]() 中是否含有少量NaCl的方法是_____。
中是否含有少量NaCl的方法是_____。
【答案】盐 纯碱(或苏打) N 不饱和 有晶体析出 硝酸铵溶于水吸收吸热,溶液的温度降低,而氯化铵的溶解度随着温度的降低而减小 先加入过量的稀硝酸,然后再滴入硝酸银溶液,若不产生白色沉淀则证明不含氯化钠,反之则含氯化钠
【解析】
氯化铵的溶解度随着温度的降低而减小,碳酸钠与硝酸银溶液反应生成碳酸银和硝酸钠,硝酸银与氯化钠反应生成氯化银和硝酸钠。
(1)碳酸钠是由金属阳离子与酸根阴离子构成的化合物,属于盐,碳酸钠俗称纯碱或苏打,NH4Cl中含有氮元素,在农业上可用作化肥。
(2)由溶解度表格数据可知,20℃时,NH4Cl的溶解度为37.2g,所以在该温度下的100g水中加入40g氯化铵得到的溶液为该温度下的饱和溶液,即A为饱和溶液;40℃时,氯化铵的溶解度为45.8g,则该溶液变成了不饱和溶液,即B为40C时的不饱和溶液;再加入5g氯化铵,仍未达到45.8g,所以C仍为40℃时的不饱和溶液;继续升温至50℃(该温度下,氯化铵的溶解度为50.4g),溶液还是不饱和溶液。
(3)NH4NO3晶体溶于水会吸收热量,溶液的温度降低,而氯化铵的溶解度随着温度的降低而减小,故小烧杯中出现的晶体,原因是硝酸铵溶于水吸收吸热,溶液的温度降低,而氯化铵的溶解度随着温度的降低而减小。
(4)碳酸钠与氯化钠均能与硝酸银溶液反应生成白色沉淀,在检验时要先排除碳酸钠对氯化钠检验的干扰,应先加入过量的稀硝酸,然后再滴入硝酸银溶液,若不产生白色沉淀则证明不含氯化钠,反之则含氯化钠。

【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
(查阅资料)
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(![]() 和
和![]() )及不溶性杂质,生产过程中需先将粗盐精制。
)及不溶性杂质,生产过程中需先将粗盐精制。
③生产原理:![]() 。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是:![]() 。
。
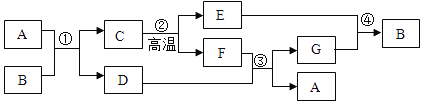
⑤部分生产流程如图所示:
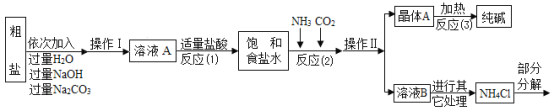
(问题讨论)
(1)①写出加入NaOH溶液所发生反应的化学方程式________。
②反应(1)中加入适量盐酸的目的是________。
(2)上述生产流程中可循环使用的物质是________(填字母)。
A![]() B NaOH C HCl D
B NaOH C HCl D![]()
(组成探究一)
(3)①晶体A受热分解的化学方程式为________。
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(装置从下图中选择)
选择的装置 | 实验现象 | 实验结论 |
________(填字母) | ________ | 样品不含晶体A |
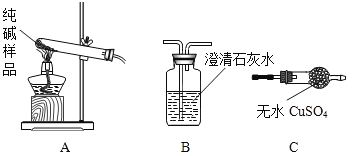
(组成探究二)
(4)取纯碱样品加水溶解,向该溶液中加入过量稀![]() ,再滴加
,再滴加![]() 溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
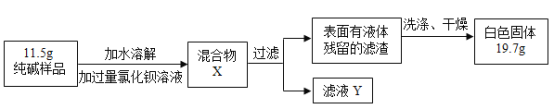
①氯化钡溶液过量的目的是________。判断氯化钡已过量的方法是________。
②判断滤渣是否洗净的方法是:取最后一次洗涤液少许于试管中,滴加________,若无沉淀产生,则已洗净。
③根据实验数据,计算样品中碳酸钠的质量分数为________(列出计算过程,保留一位小数)。