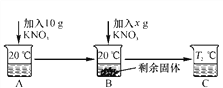
题目内容
【题目】实验室里常用锌和稀硫酸反应来制取氢气。林辉同学取6.5 g锌并加入50 g一定质量分数的硫酸溶液,恰好完全反应后,得到56.3 g硫酸锌溶液。发生反应的化学方程式是:
Zn+H2SO4=ZnSO4+H2↑。请你计算:
(1)生成氢气的质量为 g。
(2)硫酸溶液中溶质的质量分数。
【答案】(1)0.2 (2)19.6%
【解析】根据质量守恒定律可知,H2的质量=6.5 g+50 g-56.3 g=0.2 g。可根据锌(或H2)的质量求出硫酸的质量,进而计算硫酸溶液中溶质的质量分数。
(2)解:设与Zn反应的硫酸的质量为x
Zn + H2SO4=ZnSO4+H2↑
65 98
6.5 g x
![]() =
=![]() ,x=
,x=![]() =9.8 g
=9.8 g
硫酸溶液中溶质的质量分数=![]() ×100%=19.6%
×100%=19.6%

练习册系列答案
相关题目
【题目】下列说法正确的是( )
A. 任何物质都是由原子构成分子,分子构成物质
B. 分子既保持物质的物理性质,也保持物质的化学性质
C. 分子在化学变化中可以再分
D. 二氧化碳分子是由碳原子和氧分子构成的
【题目】探究小组用如图装置进行实验。胶头滴管和集气瓶中分别盛装某种试剂,挤压胶头滴管向集气瓶中滴加适量液体后,能观察到气球变大的组合是( )
选项 | 胶头滴管 中的试剂 | 集气瓶中 的试剂 |
A | 稀硫酸 | Na2CO3 |
B | 稀盐酸 | Zn |
C | 浓硫酸 | 水 |
D | NaOH溶液 | CO2 |
![]()
A. A B. B C. C D. D