题目内容
【题目】已知20 ℃时,在100 g水中达到饱和所能溶解的KNO3的最大量是31.6 g。向50 mL水(密度是1 g/mL)中溶解一定量KNO3固体如下。请回答:
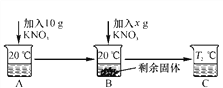
(1)A、B、C中一定是饱和溶液的是________(填字母)。
(2)当x=________g时,B中恰好没有固体剩余。
(3)硝酸钾晶体从溶液中析出常用______________的方法。
【答案】 B 5.8 降温结晶(或冷却热饱和溶液)
【解析】(1)20℃时硝酸钾的溶解度是31.6g,50mL水就是50g水,能溶解硝酸钾的质量最多是15.8g,故加入10g硝酸钾形成的A溶液是不饱和溶液,继续加入Xg硝酸钾,形成的溶液B有固体剩余,故B是饱和溶液,温度升高到T℃形成的溶液C,固体无剩余,因为不知道具体的温度,故硝酸钾可以是恰好溶解形成饱和溶液,也可能是溶解后形成不饱和溶液;(2) 20℃硝酸钾的溶解度是31.6g,50g水中最多溶解15.8g,已经加入了10g,所以还需加入硝酸钾质量为:15.8g-10g=5.8g;(3)硝酸钾的溶解度随温度升高而增大,且变化较大,所以要得到其晶体可采取降温结晶或冷却热饱和溶液的方法。

练习册系列答案
相关题目



