题目内容
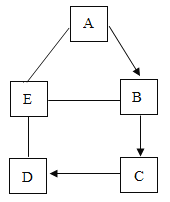
【题目】下列4个坐标图分别表示4个实验过程中的某些变化,其中正确的是( )
A.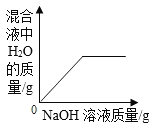 向一定量稀HCl中加入NaOH溶液
向一定量稀HCl中加入NaOH溶液
B.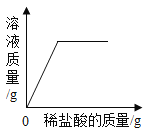 向一定量的稀盐酸中加入铁粉
向一定量的稀盐酸中加入铁粉
C.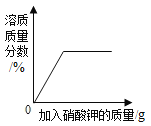 向接近饱和的硝酸钾溶液中加硝酸钾固体
向接近饱和的硝酸钾溶液中加硝酸钾固体
D.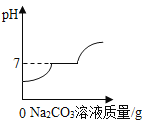 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量碳酸钠溶液
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量碳酸钠溶液
【答案】D
【解析】
A、稀HCl与NaOH溶液反应生成氯化钠和水,原溶液中含有水,水的质量不可能为0,故选项图象错误。
B、向一定量的稀盐酸中加入铁粉,生成氯化亚铁溶液和氢气,原溶液的质量不可能为0,故选项图象错误。
C、接近饱和的硝酸钾溶液中加硝酸钾固体,能继续溶解,溶质质量分数增大;当达到饱和状态后,溶质的质量分数不再发生改变,且溶质质量分数的起点不可能为0,故选项图象错误。
D、盐酸和CaCl2的混合溶液加入过量碳酸钠溶液,碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳气体,溶液的pH逐渐增大,至完全反应,pH=7;再与氯化钙反应生成碳酸钙沉淀和氯化钠,溶液的pH=7,再加入碳酸钠,碳酸钠溶液显碱性,pH大于7;故选项图象正确。
故选:D。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
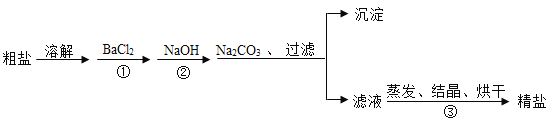
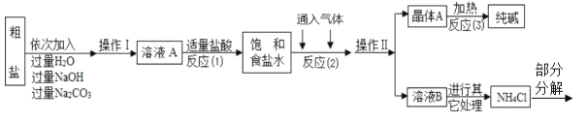
53天天练系列答案【题目】某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究过程。
(提出问题)_____________?
(作出猜想)Ⅰ.溶质仅为氯化钠;Ⅱ溶质为氯化钡和氯化钠;Ⅲ._______________。
(设计方案)
实验操作 | 现象 | 结论 |
取少量废液缸中上层清液,向其中加入一定量的______________溶液。(填化学式,限填一种) | 无明显现象 | 猜想Ⅰ正确 |
______ | 猜想Ⅱ正确 | |
有气泡产生 | 猜想Ⅲ正确 |
(交流反思)学习小组经过讨论认为,含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。请写出硝酸钡与碳酸钠反应的化学方程式___________________。
若是人误吃了可溶性钡盐,不能服用碳酸钠溶液解毒而是服用硫酸钠溶液,理由是_______。
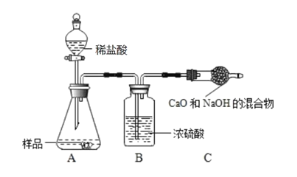
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取5g混合物,放入一干净的烧杯中,然后取50g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
生成气体的总质量/g | 0.05 | m | 0.15 | 0.18 | n |
(l)上表中m=_____、n=_____.
(2)请计算所用稀硫酸的溶质质量分数(结果保留一位小数).____
(3)固体混合物中,硫酸镁的质量分数为_____.
【题目】食品营养与安全关系到每个人的身体健康。
(1)豆浆已成为众多家庭的早餐选择,下表是豆浆中部分成分的平均含量。
成分 | 水 | 蛋白质 | 脂肪 | 糖类 | 钙 | 磷 | 铁 | 维生素 |
平均含量(%) | 96.0 | 1.8 | 0.7 | 1.1 | 0.01 | 0.03 | 0.0005 | 0.015 |
豆浆的成分中能作为机体生长、修补受损组织的原料的是________,人体缺少表中的________元素会引起贫血。
(2)霉变的花生中含有黄曲霉毒素(化学式![]() )食用后可导致癌症。黄曲霉毒素中碳、氢、氧元素的质量比是________。
)食用后可导致癌症。黄曲霉毒素中碳、氢、氧元素的质量比是________。