题目内容
【题目】下表是某科学研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | 过氧化氢溶液浓度 | 过氧化氢溶液体积/mL | 二氧化锰的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5% | 1 | 0.1 | 4 | 16.75 |
② | 15% | 1 | 0.1 | 4 | 6.04 |
③ | 30% | 5 | 0 | 2 | 49.21 |
④ | 30% | 5 | 0.1 | 2 | 10.76 |
(1)请写出过氧化氢分解的文字表达式____________________________________________________。
(2)通过实验________和实验________对比可知(填实验序号),化学反应速率与反应物的浓度有关;从实验③和④对比可知,化学反应速率与________________有关。
(3)为完成本实验,应选择下图所示气体发生装置和收集装置的组合是___________。(填序号)
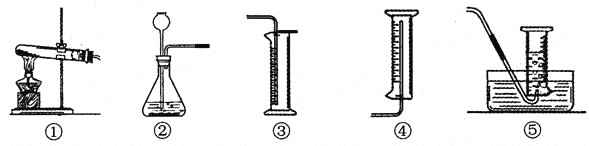
(4)【反思】过氧化氢在常温下分解缓慢,加入二氧化锰后反应明显加快。若要证明二氧化锰粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____________和_____________是否改变。
过氧化氢生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出假设和实验方案)
【假设】_________________________________________。
【实验方案】_______________________________________________________________。
【答案】 过氧化氢![]() 水+氧气 ① ② 有无催化剂 ②⑤ 质量 化学性质 过氧化氢生成氧气的快慢可能还与温度有关 取两支试管,分别加入0.1g的二氧化锰,然后再分别加入5ml 15%的过氧化
水+氧气 ① ② 有无催化剂 ②⑤ 质量 化学性质 过氧化氢生成氧气的快慢可能还与温度有关 取两支试管,分别加入0.1g的二氧化锰,然后再分别加入5ml 15%的过氧化
氢溶液,把两支试管分别分别放在20℃和40℃的环境下反应,比较产生相同体积的氧气所用的时间。
【解析】(1)过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,文字表达式为:过氧化氢![]() 水+氧气; (2)比较表格中①和②的数据在其他条件都相同时,可以看出过氧化氢的浓度对反应速率的影响;比较③和④,我们可以看出过氧化氢浓度和体积相等的条件下,在有无催化剂的条件下收集相同体积的气体所需的时间不同,有催化剂的过氧化氢分解的速率较快;(3) 过氧化氢和二氧化锰制取氧气,反应物为固体和液体,且无需加热,又因为氧气不易溶于水,所以发生装置和收集装置应选②⑤组合;(4)催化剂能改变化学反应速率,只有在化学反应前后质量和化学性质都不变才能叫做催化剂,故还需验证二氧化锰在化学反应前后质量和化学性质是否改变;【假设】过氧化氢生成氧气的快慢可能还与温度有关;【实验方案】取两支试管,分别加入0.1g的二氧化锰,然后再分别加入5ml 15%的过氧化氢溶液,把两支试管分别放在20℃和40℃的环境下反应,比较产生相同体积的氧气所用的时间。
水+氧气; (2)比较表格中①和②的数据在其他条件都相同时,可以看出过氧化氢的浓度对反应速率的影响;比较③和④,我们可以看出过氧化氢浓度和体积相等的条件下,在有无催化剂的条件下收集相同体积的气体所需的时间不同,有催化剂的过氧化氢分解的速率较快;(3) 过氧化氢和二氧化锰制取氧气,反应物为固体和液体,且无需加热,又因为氧气不易溶于水,所以发生装置和收集装置应选②⑤组合;(4)催化剂能改变化学反应速率,只有在化学反应前后质量和化学性质都不变才能叫做催化剂,故还需验证二氧化锰在化学反应前后质量和化学性质是否改变;【假设】过氧化氢生成氧气的快慢可能还与温度有关;【实验方案】取两支试管,分别加入0.1g的二氧化锰,然后再分别加入5ml 15%的过氧化氢溶液,把两支试管分别放在20℃和40℃的环境下反应,比较产生相同体积的氧气所用的时间。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案