题目内容
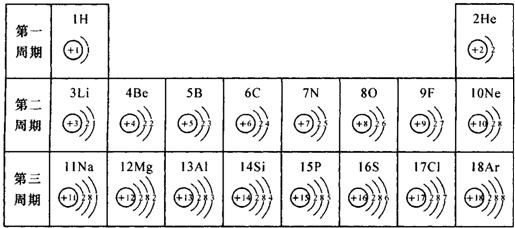
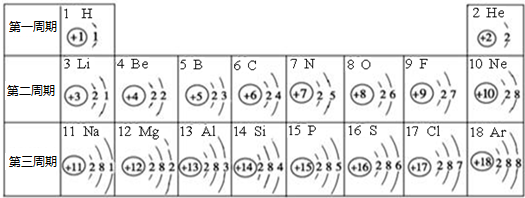
元素周期表对学习化学有重要的帮助.下表是依据元素周期表画出的原子序数1-18号元素的原子结构示意图,请回答:
| 第一周期 | 1H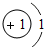 | 2He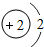 | ||||||
| 第二周期 | 3Li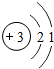 | 4Be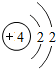 | 5B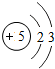 | 6C | 7N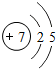 | 8O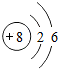 | 9F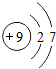 | 10Ne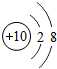 |
| 第三周期 | 11Na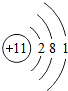 | 12Mg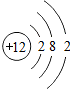 | 13Al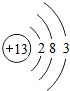 | 14Si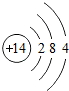 | 15P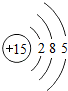 | 16S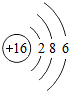 | 17Cl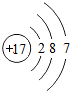 | 18Ar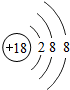 |
(2)由l2、17号元素组成的一种化合物的化学式为________.
(3)2006年世界十大科技进展中,有一项是由美国和俄罗斯科学家共同合成了原子序数为118的超重元素,则此元素的核外电子数为________.
(4)对上表进行分析研究,发现有很多规律,请写出其中两条:
例如:规律①原子序数与元素原子核电荷数相等.
规律②________.
规律③________.
解:(1)根据元素周期表可查原子序数为12的元素是镁,最外层电子数为2,在化学反应中,在化学反应中,金属元素的原子比较容易失去最外层的电子,该元素的原子易 失去,变成 Mg2+,
故答案为:镁;2;失;Mg2+;
(2)l2、17号元素分别是 Mg和CL,组成的一种化合物的化学式为 MgCl2,故答案为:MgCl2;
(3)在原子中,原子序数=质子数=核外电子数,则原子序数为118的超重元素的核外电子数为118,
故答案为:118;
(4)根据元素周期表画出的原子序数1-18号元素的原子结构示意图,观察比较可总结出规律,
故答案为:电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;金属相对集中于左偏下区域;非金属集中于右边的区域;同一周期原子的最外层电子数从左到右逐渐增加.(任写两点即可,其他合理答案也按标准给分)
分析:根据在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化,元素的种类(金属、非金属、稀有气体)和元素性质,也发生规律性的变化.
点评:本题考查根据元素周期律解题的实际应用能力.
故答案为:镁;2;失;Mg2+;
(2)l2、17号元素分别是 Mg和CL,组成的一种化合物的化学式为 MgCl2,故答案为:MgCl2;
(3)在原子中,原子序数=质子数=核外电子数,则原子序数为118的超重元素的核外电子数为118,
故答案为:118;
(4)根据元素周期表画出的原子序数1-18号元素的原子结构示意图,观察比较可总结出规律,
故答案为:电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;金属相对集中于左偏下区域;非金属集中于右边的区域;同一周期原子的最外层电子数从左到右逐渐增加.(任写两点即可,其他合理答案也按标准给分)
分析:根据在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化,元素的种类(金属、非金属、稀有气体)和元素性质,也发生规律性的变化.
点评:本题考查根据元素周期律解题的实际应用能力.

练习册系列答案
相关题目
元素周期表对学习化学有重要的帮助.下表是依据元素周期表画出的原子序数1-18号元素的原子结构示意图,请回答:
(1)原子序数为12的元素,它的名称是______,它的最外层电子数为______,在化学反应中,该元素的原子易______(选填“得”或“失“)电子,变成______(填粒子符号)
(2)由l2、17号元素组成的一种化合物的化学式为______.
(3)2006年世界十大科技进展中,有一项是由美国和俄罗斯科学家共同合成了原子序数为118的超重元素,则此元素的核外电子数为______.
(4)对上表进行分析研究,发现有很多规律,请写出其中两条:
例如:规律①原子序数与元素原子核电荷数相等.
规律②______.
规律③______.
| 第一周期 | 1H | 2He | ||||||
| 第二周期 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 第三周期 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
(2)由l2、17号元素组成的一种化合物的化学式为______.
(3)2006年世界十大科技进展中,有一项是由美国和俄罗斯科学家共同合成了原子序数为118的超重元素,则此元素的核外电子数为______.
(4)对上表进行分析研究,发现有很多规律,请写出其中两条:
例如:规律①原子序数与元素原子核电荷数相等.
规律②______.
规律③______.
元素周期表对学习化学有重要的帮助.下表是依据元素周期表画出的原子序数1-18号元素的原子结构示意图,请回答:
(1)原子序数为12的元素,它的名称是______,它的最外层电子数为______,在化学反应中,该元素的原子易______(选填“得”或“失“)电子,变成______(填粒子符号)
(2)由l2、17号元素组成的一种化合物的化学式为______.
(3)2006年世界十大科技进展中,有一项是由美国和俄罗斯科学家共同合成了原子序数为118的超重元素,则此元素的核外电子数为______.
(4)对上表进行分析研究,发现有很多规律,请写出其中两条:
例如:规律①原子序数与元素原子核电荷数相等.
规律②______.
规律③______.
| 第一周期 | 1H | 2He | ||||||
| 第二周期 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 第三周期 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
(2)由l2、17号元素组成的一种化合物的化学式为______.
(3)2006年世界十大科技进展中,有一项是由美国和俄罗斯科学家共同合成了原子序数为118的超重元素,则此元素的核外电子数为______.
(4)对上表进行分析研究,发现有很多规律,请写出其中两条:
例如:规律①原子序数与元素原子核电荷数相等.
规律②______.
规律③______.