题目内容
【题目】2.4gH2和CO的混合气体与15gO2混合后,在密闭容器中完全燃烧,再冷却至室温,测得容器中混合气体的质量为8.4g,若反应后氧气有剩余,在原混合气体中H2的质量为________ , 反应后新混合气体中O2的质量为________ .
【答案】1g 6.2g
【解析】
(1)反应生成水的质量为:15g+2.4g-8.4g=9g,
设原混合气体中H2的质量为x,
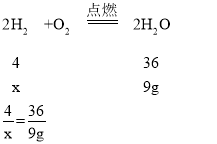
解之得:x=1g;
则用去氧气的质量为:9g-1g=8g,
(2)原混合气体中CO的质量为:2.4g-1g=1.4g,
设生成CO2的质量为y,
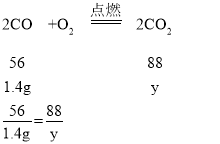
y=2.2g
则用去氧气的质量为:2.2g-1.4g=0.8g,
则剩余的氧气的质量为:15g-0.8g-8g=6.2g.
答:(1)原混合气体中H2的质量为1g;
(2)反应后剩余的氧气的质量为6.2g.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】在宏观、微观和符号之间建立联系是化学学科的特点.
(1)按要求填写指定的化学符号或符号的意义
化学符号 | 2N | _____ | 3SO42- |
符号的意义 | _____ | 2个氧分子 | _____ |
(2)如图1是1一18号元素中部分粒子的结构示意图

其中属于同种元素的是____(填序号);属于阴离子的是___;(用粒子符号表示)①和④两种元素组成的化合物的化学式是____;⑤的原子核内的中子数比核外电子数多1个,则它的相对原子质量是_____.
(3)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.探究钠元素的单质与水反应的生成物.甲同学猜想生成物为NaOH和H2;乙同学猜想生成物为NaOH和O2,经过讨论后,大家一致认为乙同学的猜想不合理,请从化合价的角度解释原因______.
(4)钙元素对人体健康很重要,是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,图2是某种品牌的补钙药品的部分说明书.请回答下列问题:
①CaCO3中碳、氧元素的质量比是_____.
②CaCO3中钙元素的质量分数为____.
③如果按用量服用,每天摄入钙元素的质量为_____.