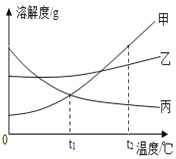
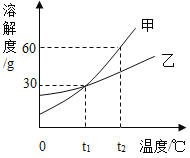
题目内容
【题目】如图所示,A是金属氧化物,B是金属单质,C是黄色溶液,D是浅绿色溶液,E是红褐色沉淀,反应③是物质F与氧气、水发生的化合反应,请回答下列问题: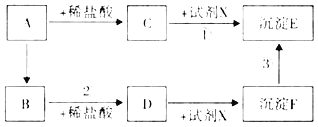
(1)写出C的化学式_____。
(2)化学反应①的基本类型是_____。
(3)写出反应②和③的化学方程式:②_____;③_____。
【答案】 FeCl3 复分解反应 Fe+2HCl=FeCl2+H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A是金属氧化物,A能和稀盐酸反应生成C,C是黄色溶液,所以A是氧化铁,C是氯化铁;氯化铁能和试剂X反应生成红褐色沉淀,则试剂X是氢氧化钠,沉淀E是氢氧化铁;A能反应生成B,B是金属单质,则B是铁单质;B能和稀盐酸反应生成D,D是浅绿色溶液,则D是氯化亚铁;D能和氢氧化钠反应生成氢氧化亚铁白色沉淀,则沉淀F是氢氧化亚铁;氢氧化亚铁能和水、氧气反应生成氢氧化铁沉淀。
(1)C是氯化铁,化学式是FeCl3;(2)反应①是氯化铁和氢氧化钠相互交换成分生成氯化钠和氢氧化铁,是复分解反应;(3)反应②是铁和稀盐酸反应生成氯化亚铁和氢气,反应③是氢氧化亚铁能和水、氧气反应生成氢氧化铁沉淀,反应的化学方程式是Fe+2HCl=FeCl2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3。

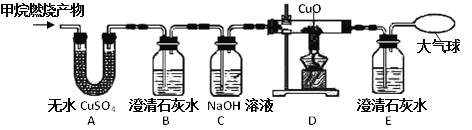
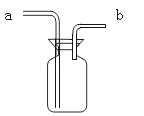
【题目】某化学兴趣小组用一定浓度的稀盐酸和含杂质5%(杂质不与盐酸反应)的石灰石制备CO2,他们选择的制取和收集装置如图所示。请按要求回答问题和探究:

(1)装置A中仪器a的名称是___,若要制取并收集干燥的CO2,导管的连接顺序是___。
(2)若消耗的石灰石为100g,理论上可得到CO2___g(精确到0.1),但实际收集到的CO2质量与理论值不符,原因可能是___(填一种)。
(3)探究装置A中残留液的溶质成分。
(提出问题)残留液中含有哪些溶质?
(查阅资料)CaCl2溶液呈中性。
(思考判断)残留液中一定含有的溶质是___(填物质名称),可能含有的溶质是HCl。
(实验验证)同学们通过多种实验方法,均验证了残留液中的溶质有HCl,请完成下表。
实验操作 | 现象(数据或化学方程式) | 结论 | |
方法一 | 用酸碱指示剂测定溶液的酸碱性,所选择的指示剂为___。 | 现象:___ | 残留液中的溶质有HCl |
方法二 | 用pH试纸测定溶液的pH。 | pH___ 7 (填“>”“=”或“<”) | |
方法三 | 用化学药品检测,且发生了复分解反应,可能选用的药品为___(填一种物质的化学式)。 | 现象:___ 化学方程式:___ |