题目内容
【题目】目前,教科书中测定空气里氧气含量的方法,无法满足严谨的科学要求.利用NO和氢氧化钠溶液可以更准确地测定空气中O2的含量.
[查阅资料]
①NO是一种无色无味,难溶于水的有毒气体.相同条件下,2体积的NO与1体积的O2完全反应,生成2体积的NO2(化学方程式为:2NO+O2═2NO2)
②氢氧化钠溶液吸收NO2生成NaNO2、NaNO3和H2O
③2FeSO4+3H2SO4+2NaNO2═Fe(SO4)3+2NaHSO4+2H2O+2NO↑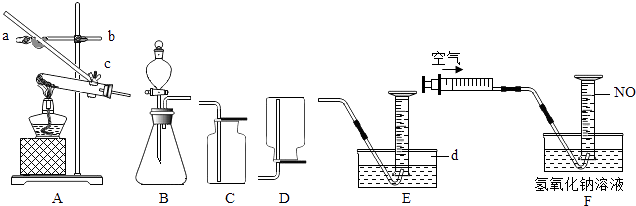
(1)写出仪器d的名称:
(2)若要调节A中试管与酒精灯相对高度,应调节螺旋(填“a”、“b”或“c”)
(3)写出氢氧化钠溶液吸收NO2反应的化学方程式:
(4)实验室用稀硫酸、NaNO2饱和溶液和FeSO47H2O固体反应制备NO,应选用的发生装置是(填序号).用E装置收集纯净的NO气体,而不用C或D装置的理由是:
(5)如图F所示,向收集有60mLNO气体的量筒中,缓慢推入20mL的空气.
用橡胶塞塞住量筒口,小心混合,使气体充分反应.1~2min后,
在液面下移开橡胶塞.2min后,观察和记录最终量筒中气体的体
积为67.4mL.则20mL空气中含有氧气mL.
操作时存在的主要安全隐患
(6)收集60mLNO气体(密度约为1.27g/L),至少需要固体NaNO2的质量是多少?
(请写出计算过程,计算结果精确到0.01g)
【答案】
(1)水槽
(2)b
(3)2NaOH+2NO2═NaNO2+NaNO3+H2O
(4)B,NO与氧气反应,密度与空气相近,且难溶于水
(5)4.2,NaOH溶液对皮肤有腐蚀性
(6)解:60mL一氧化氮的质量为:60×10﹣3L×1.27g/L=0.08g
设至少需要亚硝酸钠的质量为x
2FeSO4+3H2SO4+ | 2NaNO2═Fe2(SO4)3+2NaHSO4+2H2O+ | 2NO↑ |
138 | 60 | |
x | 0.08g |
![]()
x=0.18g
答:至少需要固体NaNO2的质量为0.18g
【解析】解:(1)据图可以看出,仪器d是水槽,故填:水槽;(2)若要调节A中试管与酒精灯相对高度,应调节螺旋b,故填:b;(3)氢氧化钠溶液吸收NO2反应生成亚硝酸钠、硝酸钠和水,故填:2NaOH+2NO2=NaNO2+NaNO3+H2O.(4)实验室用稀硫酸、NaNO2饱和溶液和FeSO47H2O固体反应制备NO,是固液常温型反应,应选用的发生装置是B;用E装置收集纯净的NO气体,而不用C或D装置是因为一氧化氮能与氧气反应且密度与空气接近.故填:B;NO能与氧气反应,密度与空气相近,且难溶于水;(5)
2NO+ | O2═ | 2NO2 |
2 | 1 | 2 |
2NaOH+2NO2=NaNO2+NaNO3+H2O
减少的气体的体积为:60mL+20mL﹣67.4mL=12.6mL
氧气的体积占减少的气体体积的三分之一,故氧气的体积为:12.6mL× ![]() =4.2mL;
=4.2mL;
由于氢氧化钠具有极强的腐蚀性,因此在实验中要注意氢氧化钠对皮肤的腐蚀性;
故填:4.2;氢氧化钠溶液对皮肤具有腐蚀性;
答案:(1)水槽;(2)b;(3)2NaOH+2NO2═NaNO2+NaNO3+H2O;(4)B; NO与氧气反应,密度与空气相近,且难溶于水;(5)4.2; NaOH溶液对皮肤有腐蚀性;(6)至少需要固体NaNO2的质量为0.18g
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号),还要掌握根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比)的相关知识才是答题的关键.
