题目内容
【题目】(1)现有六种物质,选择相应物质的字母填空:
A、大理石 B、钛合金 C、酒精 D、铁粉 E、活性炭 F、干冰
①______________可用于人工降雨; ②______________可用作建筑装饰材料;
③______________可用于制作人造骨; ④______________是实验室最常用的燃料。
(2)用化学符号填空:
①两个碳酸根离子____________________; ②硬水中含量较多的阳离子_____________(填一种);
③天然气的主要成分甲烷燃烧的化学方程式是__________________________________。
【答案】 F A B C ![]()
![]() 或
或![]()
![]()
【解析】①干冰升华时能吸收大量的热,可用于人工降雨;②熟石灰能与二氧化碳反应生成坚硬的碳酸钙可用作建筑材料;③钛合金与人体具有很好的相容性,可用作人造关节;④酒精具有可燃性,是实验室最常用的燃料;(2)①根据离子的表示方法,2个碳酸根离子表示为:![]() ;②硬水中含有大量的钙镁离子,所以硬水中含量较多的阳离子为:
;②硬水中含有大量的钙镁离子,所以硬水中含量较多的阳离子为:![]() 或
或![]() ;③甲烷燃烧生成水和二氧化碳,化学方程式为:
;③甲烷燃烧生成水和二氧化碳,化学方程式为:![]()
![]()
![]() 。
。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】二氧化碳与二氧化硫同为非金属氧化物,某兴趣小组用类比法进行如下探究:
探究一SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是(填序号,可多选).
A.反应物的状态
B.反应条件
C.气体密度
D.气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验.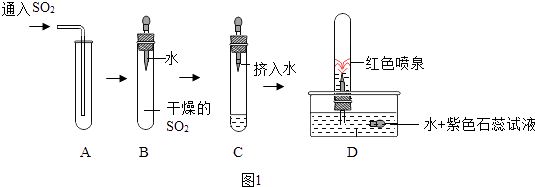
通过上述实验,可推测SO2气体的性质有:
① .
②等合理答案.
探究二 CO2和SO2性质的比较
兴趣小组设计并进行如图2实验,探究比较CO2和SO2的化学性质.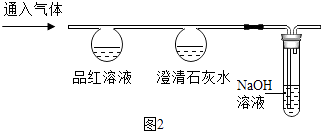
实验Ⅰ | 实验Ⅱ | |
通入CO2 | 通入SO2 | |
品红溶液 | 无明显变化 | 红色褪为无色 |
澄清石灰水 | 白色浑浊 | 白色浑浊 |
(3)由实验可知:
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式 .
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去是SO2 , 无明显变化的是CO2③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其 .
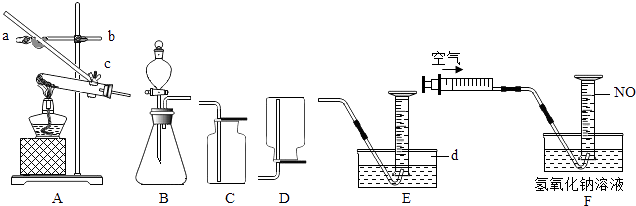
(4)探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色.
②二氧化硫与碘水反应的化学方程式为:
(SO2、I2的相对分子质量分别为:64、254).
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
SO2最高浓度限值(单位mg/m3) | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0.70 |
(5)测定步骤:
Ⅰ.检查装置的气密性.
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2﹣3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)
由实验可知:
①当溶液由变成无色时反应恰好完全.
②由此可计算空气中SO2的含量mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于标准(填上表中所列举的等级).