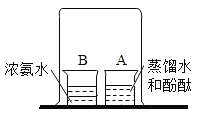
题目内容
【题目】某兴趣小组利用实验室制CO2的废液得到CaCO3和NaCl晶体,过程如下:
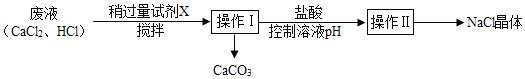
下列说法中正确的是( )
A. 试剂X可选用Na2CO3溶液
B. 操作Ⅰ、Ⅱ的名称都是过滤
C. 操作I需要用到的玻璃仪器有玻璃棒、漏斗和量筒
D. 稍过量的试剂X加入到废液中观察到的现象是先有沉淀后有气泡
【答案】A
【解析】
A. 实验室制CO2的废液中含有CaCl2,加入试剂X得到CaCO3和NaCl,根据质量守恒定律,X选用的是Na2CO3溶液,Na2CO3+CaCl2== CaCO3↓+2NaCl,此选项正确;
B. 通过操作Ⅰ使难溶解于水的固体物质与液体分离,则操作Ⅰ是过滤,通过操作Ⅱ是从NaCl溶液中得到NaCl晶体,则操作Ⅱ是蒸发,此选项错误;
C. 操作I是过滤,过滤时需要用到的玻璃仪器有玻璃棒、漏斗和烧杯,此选项错误;
D. 稍过量的Na2CO3溶液加入到废液中观察到的现象是先有气泡后有沉淀,此选项错误。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】胃舒平(含Al(OH)3)、小苏打片(含NaHCO3)、胃酸抑制剂(主要含CaCO3、Mg(OH)2)都是常用的中和胃酸的药物。
(1)胃舒平与胃酸发生反应的化学方程式为:_____。
(2)为了探究工业小苏打中是否含少量的NaCl,设计如下实验:(假设小苏打片中其他物质均不含Cl-)
实验步骤 | 实验现象 | 实验结论 |
第一步:取1片小苏打于试管中,加入适量水充分溶解,再滴加足量的稀HNO3。 | 有_____产生 | 说明小苏打片中含有NaHCO3。 |
第二步:再往上述溶液中滴加少量_____溶液。(写化学式) | 有_____产生 | 说明小苏打片中含有NaCl。 |
(3)胃酸抑制剂每片lg,取10片于烧杯中,再加入50g稀HCl,烧杯中剩余物的质量与时间的关系如下表:(已知其他物质不与稀盐酸反应)
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
剩余物的质量/g | 60 | 59.12 | 58.24 | 57.36 | 56.48 | 56.48 |
求每片胃酸抑制剂中CaCO3的质量分数_____(写出计算过程)。