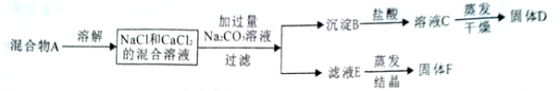
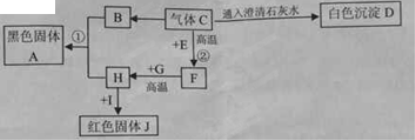
题目内容
【题目】(9分)水与人类的生活和生产密切相关,请回答下列问题:
(1)活性炭常用于净水,其作用是 、过滤水中的杂质。下列净化水的方法中,净化程度最高的是 (填序号)。
A.吸附 B.沉淀 C.过滤 D.蒸馏
(2)用蒸馏水润湿的pH试纸测定氢氧化钠溶液的pH,测量结果会 (填“偏大”、“不变”、“偏小”)。
(3)“节约用水,从我做起。”请你任举一例生活中节约用水的措施 。
(4)下图为A、B、C三种物质的溶解度曲线,据图回答:
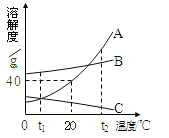
①t2℃时,A、B、C三种物质的溶解度由大到小顺序是 。
②将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是 ,无溶质析出的是 。
③20℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是 g。
④若将t1℃三种物质的饱和溶液分别升温到t20C时,则三种溶液中溶质的质量分数由大到小的顺序是 。
【答案】(1)A D (2)偏小 (3)一水多用(合理即可)
(4)①A>B>C ② A C ③70 ④B>A>C
【解析】
试题分析:(1)活性炭常用于净水,其作用是吸附,选A;净化水的方法中,净化程度最高的是蒸馏,选D (2)用蒸馏水润湿的pH试纸测定氢氧化钠溶液的pH,相当于将氢氧化钠溶液稀释了,碱性减弱,PH变小,故测量结果会偏小
(3)生活中节约用水的措施:一水多用(合理即可)
(4)①根据溶解度曲线,t2℃时,A、B、C三种物质的溶解度由大到小顺序是:A>B>C
②根据溶解度曲线,A物质的溶解度随温度变化的趋势最小,而C物质的溶解度随温度的升高而降低,故将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是A ;无溶质析出的是C ③根据溶解度曲线,20℃时,A物质的溶解度40g,表示在20℃时,100g水中达到饱和状态溶解A的质量为40g,故50g水中最多只能溶解20g,所以将30g A物质放入50g水中,充分搅拌,所得溶液的质量是70g
④根据溶解度曲线,物质A、B的溶解度都随温度的升高而增大,故将t10C时A、B两种物质的饱和溶液分别升温到t20C时,都由饱和溶液变为不饱和溶液,,但溶液中的溶质、溶解质量都不变,而在t10C 时:B的溶解度大于A,故溶质质量分数B也大于A,而对于c而言,溶解度随温度的升高而降低,故t10C升温到t20C,有晶体析出,故溶质质量分数减小,成为t20C时的饱和溶液,而在t20C时,物质C的溶解度要小于t10C时A的溶解度,故C的溶质质量分数最小,故若将t10C三种物质的饱和溶液分别升温到t20C时,则三种溶液中溶质的质量分数大小关系是:B>A>C

【题目】分类是学习和研究化学的常用方法。下列分类中正确的是
A.有机物:甲烷、乙醇、葡萄糖
B.复合肥料:尿素、硝酸钾、磷酸氢二铵
C.混合物:煤、石油、冰水共存物
D.合成材料:合金、合成橡胶、合成纤维
【题目】(9分)某学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。
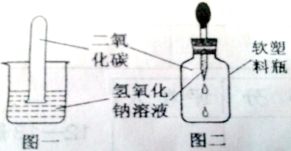
【提出问题】氢氧化钠能否与二氧化碳反应?
【猜想与假设】亮亮同学认为氢氧化钠能与二氧化碳反应;莉莉同学认为氢氧化钠不能与二氧化碳反应。
【设计与实验】亮亮同学设计了两个装置并进行实验。请你和他一起验证他的猜想。
实验步骤 | 实验现象 | 实验结论 |
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | ||
如图二, |
【反思与评价】莉莉同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
【设计与实验】请你设计一个实验,证明氢氧化钠确实与二氧化碳反应。
实验步骤 | 实验现象 | 实验结论 |
氢氧化钠与二氧化碳反应 |
【交流与提高】实验证明氢氧化钠还能与二氧化硫反应,化学方程式为:
2NaOH+SO2=X+H2O,X的化学式是 。