题目内容
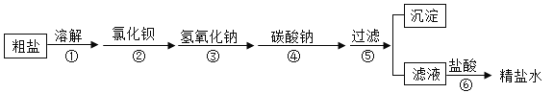
【题目】现实验室中有一包由碳酸钠和氧化钙组成的白色粉末,下面是某化学兴趣小组的同学进行的探究过程,请你按要求帮助完成探究活动。
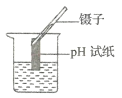
同学们将部分白色固体放于烧杯中加入少量的水,发现烧杯外壁有热感,加水放热的反应的化学方程式是_______________。继续加入足量的水并过滤,用pH试纸测定滤液的pH, pH_______________7 (选填“>、=、<”)。滤液呈碱性。
(提出问题)滤液中含有那些碱性物质?
(提出猜想)
猜想①: NaOH
猜想②: NaOH 和Na2CO3
猜想③: NaOH和Ca(OH)2
猜想④: NaOH、Ca(OH)2 和Na2CO3
[查阅资料] Na2CO3溶液呈碱性
(实验探究)
(1)甲同学认为猜想④不合理,原因是__________________(用化学方程式表示)。
(2)乙同学进行下列实验,请你填写表中空白处。
实验操作步骤 | 实验现象 | 结论 |
I.取用少量滤液于试管中,通入CO2 | 没有明显变化 | 滤液不含_________。 |
Ⅱ.取用少量滤液于试管中,滴加过量CaCl2溶液,后滴入无色酚酞试液 | ____________ | 滤液含有Na2CO3;反应的化学方程式是_____________。 |
_____________ | 滤液含有NaOH。 |
(获得结论)猜想②成立
(反思拓展)
实验操作步骤Ⅱ中加入过量CaCl2溶液的目的是__________________________。
【答案】![]() >
> ![]() Ca(OH)2 产生白色沉淀
Ca(OH)2 产生白色沉淀 ![]() 溶液呈红色 检验并除去Na2CO3
溶液呈红色 检验并除去Na2CO3
【解析】
氧化钙与水反应生成氢氧化钙,放出热量,该反应的化学方程式为:![]() ;
;
溶液呈碱性,故pH>7;
实验探究:(1)甲同学认为猜想④不合理,原因是:氢氧化钙能与碳酸钠反应生成碳酸钙和氢氧化钠,不能共存,该反应的化学方程式为:![]() ;
;
(2)I、取用少量滤液于试管中,通入CO2,氢氧化钙能与二氧化碳反应生成碳酸钙和水,无明显现象,说明滤液不含氢氧化钙;
Ⅱ、实验结论为:滤液含有碳酸钠、氢氧化钠,故取用少量滤液于试管中,滴加过量CaCl2溶液,后滴入无色酚酞试液,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,故实验现象为:产生白色沉淀,该反应的化学方程式为:![]() ,滤液中含氢氧化钠,氢氧化钠显碱性,能使无色酚酞溶液变红,故实验现象为:溶液呈红色;
,滤液中含氢氧化钠,氢氧化钠显碱性,能使无色酚酞溶液变红,故实验现象为:溶液呈红色;
反思拓展:实验操作步骤Ⅱ中加入过量CaCl2溶液的目的是:检验并除去碳酸钠。

【题目】水是生命的源泉,为了人类社会的可持续发展,我们应该了解水的有关知识。

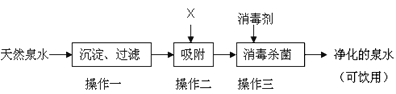
(1)天然水中含有许多杂质,自来水厂通常对天然水进行、______、等几步处理,使之达到饮用水标准,在实验室里,若要得到净化程度最高的水,可用_____的方法。如下图所示的两个实验中,发生物理变化的是实验_____;实验B中没有发生改变的微粒是_____,试管2中得到的气体是_____。所以,你认为保持水化学性质的最小粒子_____。
(2)节约用水是每个公民的义务,我们应该提倡以下方式中的_____(填字母序号)。
A 用淘米水、洗菜水浇花、冲厕所
B 不间断地放水洗衣服
C 不间断地放水刷牙
D 用喷灌、滴灌的方法浇灌农田和园林
(3)实验室中有一杯含有MgCl2和CaCl2的硬水,下表是某兴趣小组设计软化硬水的实验方案,请你一起来完成下表。可供选用的药品有Ca(OH)2溶液、NaOH溶液、Na2CO3溶液、肥皂水。
实验操作 | 现象 | 结论或化学方程式 |
①取少量硬水样品于试管中,向其滴加Ca(OH)2溶液,直到不再产生沉淀 | 有白色沉淀产生 |
|
②再向上述试管中滴加____,直到不再产生沉淀 | 有白色沉淀产生 | 化学方程式:____ |
③过滤 | 滤出沉淀 | 得到澄清滤液 |
④用两试管分别取等量的上述滤液和原硬水样品,分别滴加____振荡 | 盛有滤液的试管中____ | 证明硬水已软化 |