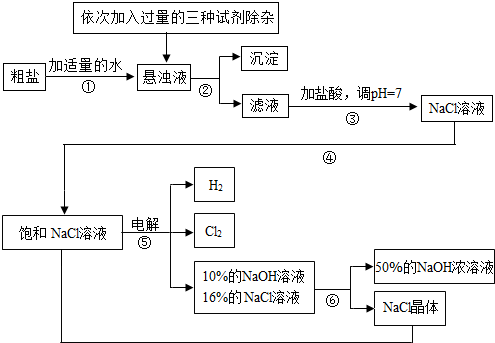
题目内容
 (2012?曲阜市模拟)实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液.反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示.请计算:
(2012?曲阜市模拟)实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液.反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示.请计算:(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体
21.2
21.2
g.(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
分析:(1)根据溶质质量分数的计算公式,可计算配制26.5%的Na2CO3溶液80g,需要Na2CO3固体的质量;
(2)向BaCl2溶液滴加Na2CO3溶液,二者能发生复分解反应生成沉淀,其方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,根据题给数据及图示,利用化学方程式求得BaCl2溶液的溶质质量分数.
(2)向BaCl2溶液滴加Na2CO3溶液,二者能发生复分解反应生成沉淀,其方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,根据题给数据及图示,利用化学方程式求得BaCl2溶液的溶质质量分数.
解答:解:(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体的质量为:80g×26.5%═21.2g
(2)从图中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g.
设BaCl2的质量为 x,则
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 106
x 40g×26.5%
=
解得:x=20.8g
该BaCl2溶液的溶质质量分数为:
×100%=13.9%
答:(1)21.2g;(2)该BaCl2溶液的溶质质量分数为13.9%.
(2)从图中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g.
设BaCl2的质量为 x,则
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 106
x 40g×26.5%
| 208 |
| 106 |
| X |
| 40g×26.5% |
该BaCl2溶液的溶质质量分数为:
| 20.8g |
| 150g |
答:(1)21.2g;(2)该BaCl2溶液的溶质质量分数为13.9%.
点评:本题是一种综合性的题型,将溶液、化学反应和图象融合在一起,有一定的难度,要求比较高.通常学生在计算时常常会忽视了实际参加反应的是溶液中溶质的质量,而往往会把40g直接代入化学方程式进行计算.这就要求学生足够细心、会分析、且条理分明.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目