题目内容
大多数金属是通过冶炼金属矿物得到的.
(1)我国西汉时期《淮南万毕术》中记载,“曾青得铁则化为铜”,这是现代湿法冶金的先驱,写出发生的化学反应方程式
(2)铝土矿的主要成分是Al2O3,以铝土矿制金属铝一般使用电解的方法,其原理是
(用化学方程式表示).
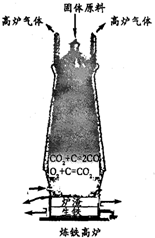
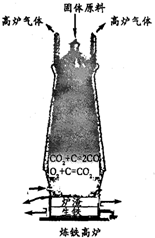
(3)①工业冶炼生铁的设备是
②某炼铁厂用含Fe2O3 480吨的赤铁矿为原料,可以炼得含杂质4%的生铁多少吨?
(1)我国西汉时期《淮南万毕术》中记载,“曾青得铁则化为铜”,这是现代湿法冶金的先驱,写出发生的化学反应方程式
Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
,该反应属于置换反应
置换反应
反应(填基本反应类型).(2)铝土矿的主要成分是Al2O3,以铝土矿制金属铝一般使用电解的方法,其原理是
2Al2O3
4Al+3O2
| ||
2Al2O3
4Al+3O2
| ||
(用化学方程式表示).
(3)①工业冶炼生铁的设备是
高炉
高炉
,原料有铁矿石、焦炭
焦炭
、石灰石、空气等.②某炼铁厂用含Fe2O3 480吨的赤铁矿为原料,可以炼得含杂质4%的生铁多少吨?
分析:(1)根据书写化学方程式的原则及方法、置换反应的定义分析
(2)根据书写化学方程式的原则及方法写出方程式
(3)根据炼铁设备及原料分析
(4)根据化学方程式已知氧化铁的质量可求出铁的质量,进而求出生铁的质量.
(2)根据书写化学方程式的原则及方法写出方程式
(3)根据炼铁设备及原料分析
(4)根据化学方程式已知氧化铁的质量可求出铁的质量,进而求出生铁的质量.
解答:解:(1)“曾青得铁则化为铜”,是指铁与硫酸铜溶液反应将铜置换出来,化学反应方程式 Fe+CuSO4═Cu+FeSO4
,该反应中反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于 置换反应反应.
(2)铝土矿的主要成分是Al2O3,在通电的条件下能生成铝和氧气,化学方程式为 2Al2O3
4Al+3O2
(3)①工业冶炼生铁的设备是 高炉,原料有铁矿石、焦炭、石灰石、空气等.
(4)解:设可以炼得含杂质4%的生铁的质量为x
3CO+Fe2O3
2Fe+3CO2
160 112
480t x×(1-4%)
=
x=350t
答:可以炼得含杂质4%的生铁350t.
故答案为:(1)Fe+CuSO4═Cu+FeSO4 置换反应.
(2)2Al2O3
4Al+3O2
(3)①高炉 焦炭
②350吨
,该反应中反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于 置换反应反应.
(2)铝土矿的主要成分是Al2O3,在通电的条件下能生成铝和氧气,化学方程式为 2Al2O3
| ||
(3)①工业冶炼生铁的设备是 高炉,原料有铁矿石、焦炭、石灰石、空气等.
(4)解:设可以炼得含杂质4%的生铁的质量为x
3CO+Fe2O3
| ||
160 112
480t x×(1-4%)
| 160 |
| 480t |
| 112 |
| x×(1-4%) |
x=350t
答:可以炼得含杂质4%的生铁350t.
故答案为:(1)Fe+CuSO4═Cu+FeSO4 置换反应.
(2)2Al2O3
| ||
(3)①高炉 焦炭
②350吨
点评:本题考查了与铁有关的相关知识,包括铁的冶炼、计算、以及铁的化学性质.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
 金属是一类重要的材料,人类的日常生产和生活都离不开金属.
金属是一类重要的材料,人类的日常生产和生活都离不开金属.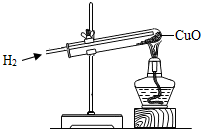 在自然界里大多数金属是以化合物的形式存在的.常用的金属冶炼是通过氢气、一氧化碳、碳粉与金属氧化物在高温下反应来实现的.小明在实验室里做氢气还原氧化铜的实验,请回答以下有关问题:
在自然界里大多数金属是以化合物的形式存在的.常用的金属冶炼是通过氢气、一氧化碳、碳粉与金属氧化物在高温下反应来实现的.小明在实验室里做氢气还原氧化铜的实验,请回答以下有关问题: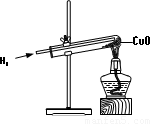
 金属是一类重要的材料,人类的日常生产和生活都离不开金属.
金属是一类重要的材料,人类的日常生产和生活都离不开金属.