题目内容
【题目】请结合下列装置图回答问题:

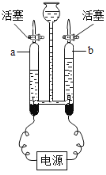
①若向A装置中通入纯净的氢气,为检验反应产物,A装置的右边应与上面的 (21)(填字母)装置连接,所选装置中出现的实验现象为 (22) 。
②若向A装置中通入纯净的一氧化碳气体,为检验反应产物,A装置的右边应与上面的(23) (填字母)装置连接。仅用上述装置进行实验有明显的安全隐患,要弥补这个缺陷,应采取的措施是 (24) 。
③现有一无色气体,可能是由一氧化碳、二氧化碳、水蒸气中的一种或几种组成。为确定其组成,按气体通过的先后顺序,连接的仪器依次是:气体→A→B→C,实验过程分析如下:
装置A中黑色氧化铜粉末变红色,该反应的化学方程式为 (25) ;装置B中无明显现象;装置C中澄清石灰水变浑浊,反应的化学方程式 (26) ;由上述实验现象并不能确定原无色气体中是否含有二氧化碳气体,原因是 (27) 。
④如果氧化铜中混有铜粉,为了测氧化铜的质量分数,称取m g样品实验,实验过程中获取两组数据:Ⅰ.反应前后仪器a中质量减少w g;Ⅱ.吸收生成物的装置中质量增加Q g。
假设还原氧化铜的反应充分,称量准确,你认为应选择 (28) 组的数据来计算样品中氧化铜的质量分数更好,理由是 (29) 。
【答案】(21)B;(22)无水硫酸铜粉末由白色变成蓝色;(23)C;(24)对尾气进行处理(C装置导管出口处点燃;C装置导管口套接一个气球或塑料袋);
(25)![]() ;(26)
;(26)![]() ;
;
(27)混合气体中含有一氧化碳气体,一氧化碳与氧化铜反应产生二氧化碳气体;
(28)Ⅰ;(29))因为数据Ⅰ在题意前提下,其他因素对其影响小;数据Ⅱ在同样前提下,如果生成物吸收不完全,对计算结果影响就大,所以实验数据Ⅰ比Ⅱ可靠.
【解析】
试题分析:①氢气和氧化铜反应生成铜和水,水和硫酸铜反应生成蓝色的五水硫酸铜;
②一氧化碳与氧化铜反应生成铜和二氧化碳,二氧化碳与澄清石灰水反应生成不溶于水的碳酸钙;一氧化碳有毒不能直接排放到空气中防止污染空气,应对尾气进行处理;
③装置A中黑色氧化铜粉末变红色,说明一氧化碳和氧化铜反应生了铜和二氧化碳,反应的化学方程式:![]() ;装置C中澄清石灰水变浑浊,反应的化学方程式为:
;装置C中澄清石灰水变浑浊,反应的化学方程式为:![]() ;由上述实验现象并不能确定原无色气体中是否含有二氧化碳气体,原因是混合气体中含有一氧化碳气体,一氧化碳与氧化铜反应产生二氧化碳气体使澄清的石灰水变浑浊;
;由上述实验现象并不能确定原无色气体中是否含有二氧化碳气体,原因是混合气体中含有一氧化碳气体,一氧化碳与氧化铜反应产生二氧化碳气体使澄清的石灰水变浑浊;
④反应前后仪器a中减少的质量是氧化铜中氧元素的质量,能完全被还原出来;C装置中增加的质量应该是生成的二氧化碳的质量,在实验过程中有可能吸收不完全,如果氧化铜中混有铜粉,为了测氧化铜的质量分数,选择Ⅰ组的数据来计算样品中氧化铜的质量分数更好,理由是因为数据Ⅰ在题意前提下,其他因素对其影响小;数据Ⅱ在同样前提下,如果生成物吸收不完全,对计算结果影响就大.所以实验数据Ⅰ比Ⅱ可靠.

【题目】(1)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
实验编号 | 试剂 | 前10 min 内产生的氢气体积(mL) | |
不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
a | 纯锌 | 30 mL 30 % | 564.3 |
b | 含杂质的锌 | 30 mL 30 % | 634.7 |
c | 纯锌 | 30 mL 20 % | 449.3 |
d | 纯锌 | 40 mL 30 % | 602.8 |
①比较实验a和实验b,可以得到的结论是 。
②为了研究硫酸浓度对反应快慢的影响,需比较实验 和实验 (填编号)。
③控制其他条件相同,需控制的条件是 (例举一种条件即可)。
(2)利用锌皮和稀硫酸制取氢气,并测定锌皮中锌的质量分数
制取氢气的实验操作有:
a.收集气体;
b.向锥形瓶里装锌皮;
c.连接仪器,检查装置气密性;
d.向长颈漏斗中注入稀硫酸;
e.装配仪器。
正确的操作顺序为 。
(3)测定锌皮中锌的质量分数:已知该锌皮中含有少量杂质铁,将该锌皮放入如下图所示的盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
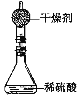
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌皮质量 | |
342.2g | 15.8g | 357.5g |