题目内容
【题目】实验室现有氯化镁和氯化钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数先称取该混合物样品20克,完全溶于127.8g水中,然后取用了一定溶质质量分数的氢氧化钠溶液100克平均分五次加入其中,充分振荡。实验所得数据见下表,请分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 | 5 |
加入氢氧化钠溶液的质量/克 | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/克 | 1.45 | x | 4.35 | 5.8 | 5.8 |
(1)上表中x的数值为_______克。
(2)计算原固体混合物样品中氯化镁的质量分数是多少_______?
(3)计算第四次加入氢氧化钠溶液,充分反应后所得溶液的溶质质量分数_______?
【答案】2.9 47.5% 10%
【解析】
解:(1)由表格数据可知,每加入20g氢氧化钠,产生沉淀1.45g,第2次累计加入40g氢氧化钠,产生沉淀质量=1.45g+1.45g=2.9g;
(2)累计产生氢氧化镁质量为5.8g
设:氯化镁的质量为x,生成的氯化钠的质量为y
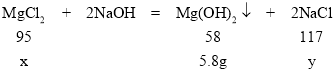
![]()
x=9.5g
![]()
y=11.7g
原固体混合物样品中氧化镁的质量分数=![]() ×100%=47.5%
×100%=47.5%
(3)第四次加入氢氧化钠溶液,充分反应后所得溶液
的溶质质量分数=![]() ×100%=10%
×100%=10%
充分反应后所得氯化钠溶液的溶质质量分数10%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
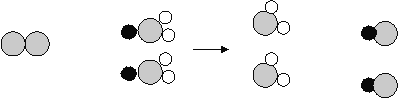
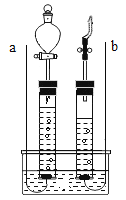
小学生10分钟应用题系列答案【题目】某校化学兴趣小组的同学发现长期露置在空气中的金属M表面会被锈蚀,于是 他们一起探究金属M锈蚀的原因.经检测,锈蚀物中除含有M元素外,还含有C、H、O三种元 素.他们分析与金属M发生反应生成锈蚀物的物质.请你参与并回答:
推测Ⅰ:(1)根据锈蚀产物的组成元素,可推测空气中的______肯定参加了反应.推测Ⅱ:由于锈蚀产物中的O元素可能有多种来源,因此不能确定空气中的氧气是否参加了反应.
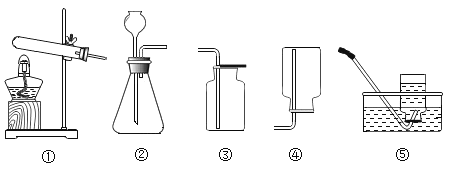
(2)为了验证空气中的氧气是否参加了反应,设计了如下系列实验(见下图),你认为其中必须要做的实验是______(填实验编号)(说明①所用蒸馏水是煮沸迅速冷却的②固体干燥剂吸收水分,不吸收二氧化碳和氧气.)实验的结果是氧气参加了反应.
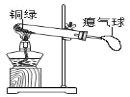
(3)若金属M是铜,铜器长期露置在空气中会生成铜绿,它的主要成份是碱式碳酸铜,化学式为Cu2(OH)2CO3,试写出铜在空气中锈蚀的化学反应方程式______
(4)兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿[化学式为Cu2(OH)2CO3],甲同学从铜片上刮下一些铜绿进行如下探究,请填写下表中空白:
实验步骤 | 实验现象 | 实验结论 |
取少量铜绿在下图装置中加热。
| 试管内壁有水雾。 | ①铜绿加热产生______。 |
② ______。 | 铜绿加热后生成氧化铜。 | |
气球胀大。 |
【题目】甲、乙、丙三种物质只通过一步反应,不能实现如图所示的转化关系的是( )

甲 | 乙 | 丙 | |
A | C | CO | CO2 |
B | NaOH | Na2CO3 | Na2SO4 |
C | CuO | Cu | Cu(NO3)2 |
D | H2SO4 | H2 | H2O |
A.A B.B C.C D.D