题目内容
【题目】(1)老师为同学们提供了如图1实验装置:

①写出带有标号的仪器名称:a_____;b_____。
②实验室制取CO2应选用的发生装置是_____(填选项字母,下同),收集装置是_____。
(2)小伟设计了如图2所示的装置进行实验(固定装置已略去,且石灰石中杂质不反应)。
①写出甲试管中发生反应的化学方程式:_____;
②小伟观察到乙试管中紫色石蕊溶液变红,请写出所有可能使其变红的原因。
①_____;
②_____。
【答案】试管 集气瓶 B E CaCO3+2HCl=CaCl2+CO2↑+H2O 二氧化碳与水反应生成碳酸使紫色石蕊试液变红色 浓盐酸具有挥发性,挥发出的氯化氢气体与水形成盐酸,盐酸能使紫色石蕊试液变红色
【解析】
解:(1)①a是试管;b是集气瓶;
②实验室制取CO2用大理石和稀盐酸常温反应,属于固-液常温型,故选发生装置B,二氧化碳的密度比空气大且能溶于水,故用向上排空气法收集;故选收集装置E;
(2)①碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
②紫色石蕊溶液变红的原因有两个:碳酸使紫色石蕊试液变红色;盐酸有挥发性,挥发出来的氯化氢气体溶于水形成盐酸,盐酸能使紫色石蕊试液变红色。

【题目】某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:
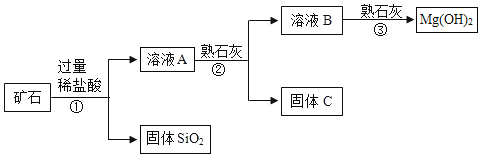
回答下列问题:
(1)步骤①和步骤②均用到的操作是_____。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和_____(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的pH范围为_____,固体C中所含成分的化学式为_____。
(4)步骤③制得Mg(OH)2的化学方程式为_____。
【题目】下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
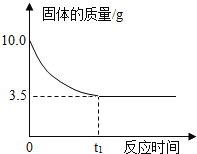
⑴影响固体物质溶解度大小的因素有______、______、______。
⑵30℃时KNO3溶液的溶质质量分数的最大值是 _____(只列出表达式)。
⑶90℃时,将一定质量的KNO3溶液按图示进行操作:
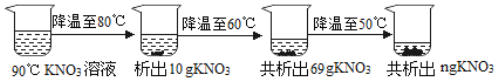
90℃时的KNO3溶液是_______(填“饱和”或“不饱和”)溶液。图中n的数值为______。
⑷30℃时,将等质量10%的KNO3溶液与20%的KNO3溶液混合后,质量分数为_____。