题目内容
【题目】某化学兴趣小组围绕“酸和碱的反应”,做了如下图所示的两个实验。
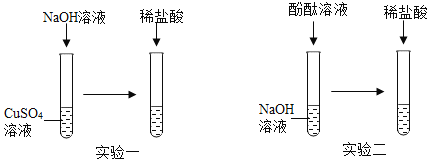
(1)实验一:向CuSO4溶液中滴入NaOH溶液,观察到的现象为 ,该反应的化学方程式为 ,继续滴加稀盐酸,通过稀盐酸与 反应的现象,证明了酸和碱能发生反应。
(2)向NaOH溶液中滴入几滴酚酞溶液,振荡,继续加入稀盐酸,观察到溶液由 色变为无色,由此现象也证明了酸和碱能发生反应。
实验结束后,小组同学对实验二中试管内的无色溶液成分展开了讨论。
【提出问题】试管中无色溶液的溶质除酚酞外还有什么?
【猜想假设】猜想一:NaCl和HCl
猜想二:
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的的是 。
A.紫色石蕊溶液 B.Cu C.AgNO3 D.Na2CO3
【讨论交流】小莹同学认为滴入NaOH溶液,也能证明猜想一成立,你认为小莹同学的方案是否可行并说明理由 。
【答案】(1)有蓝色沉淀生成 2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4Cu(OH)2(或氢氧化铜)
(2) 红
【猜想假设】NaCl
【实验设计】B、C
【讨论交流】可行,若滴加氢氧化钠溶液后没有立即变红则说明猜想一成立
【解析】
试题分析:(1)向CuSO4溶液中滴入NaOH溶液,观察到的现象为有蓝色沉淀生成;该反应的化学方程式为:2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4;继续滴加稀盐酸,发现蓝色沉淀逐渐消失;通过稀盐酸与Cu(OH)2(或氢氧化铜)反应的现象,证明了酸和碱能发生反应
(2)无色酚酞溶液遇碱溶液变红,故向NaOH溶液中滴入几滴酚酞溶液,振荡,溶液变红,继续加入稀盐酸,发生中和反应:NaOH+HCl=NaCl+H2O;故观察到溶液由红色变为无色,由此现象也证明了酸和碱能发生反应
【猜想假设】由于试管中溶液是无色的,故可判断一定不含NaOH,故要不盐酸恰好反应,要不盐酸过量,故猜想二:NaCl
【实验设计】若要证明猜想一成立,实际就是抓住酸的化学性质,证明盐酸是否存在
A、加入紫色石蕊溶液,看是否变红,若变红是,说明酸过量,可以达到目的,B、Cu排在氢后,不会与酸反应,故无法判断酸是否存在,无法达到目的,C、AgNO3是检验氯离子的存在,但不管是否存在HCl,溶液中加入AgNO3一定会有白色沉淀生成,因为有NaCl,错误,故无法达到目的,D、加入Na2CO3可以判断HCl的存在,故选B、C
【讨论交流】滴入NaOH溶液,也能证明猜想一成立,若滴加氢氧化钠溶液后没有立即变红,说明所加的氢氧化钠溶液被盐酸反应掉了,则说明猜想一成立

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案