题目内容
(3分)黄铜是由铜和锌所组成的合金,用途广泛。某兴趣小组为探究黄铜合金的组成,取20.00 g粉末状黄铜合金样品,把60.00 g稀硫酸平均分成三等份,分三次加入样品中,均有气体产生,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
|
|
第一次 |
第二次 |
第三次 |
|
剩余固体的质量/g |
16.75 |
13.50 |
12.40 |
请计算:(要求写出计算过程)
(1)该黄铜合金中,锌元素的质量分数。
(2)第二次实验中放出气体的质量。
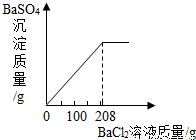
(3)向三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀。所得沉淀的质量与BaCl2溶液质量的关系如右图所示,求所用BaCl2溶液的溶质质量分数。
(1)38% (2)0.1 g (3)15%
【解析】
试题分析:(1)铜和锌所组成的和金中,锌和稀硫酸反应,铜不和稀硫酸反应;根据表格中的数据可知,前两次,当每次加入20g稀硫酸时,固体质量都减少20g-16.75g=3.25g,说明每次锌都反应掉3.25g,按此比例,那么第三次,应该剩余固体质量为13.50g-3.25g=10.25g,但由表格中第三次的数据可知,剩余固体质量为12.40g,说明此时,锌已完全反应,剩余的固体为不反应的铜。所以由表格可知铜的质量为12.40g,则锌的质量=20.00g-12.40g=7.60g,则锌元素的质量分数=  ×100%=
×100%= ×100%=38%;
×100%=38%;
(2)从表格中可知,第一次和第二次之间固体减少了的质量即是与20g稀硫酸反应的锌的质量,由此根据化学方程式中已知的反应物的质量,可求得生成的气体的质量。
由表格可知,第一次剩余固体16.75g,第二次为13.50g,说明第二次反应的锌的质量为16.75-13.50=3.25g;
设第二次实验中放出气体的质量为X,根据题意得:
Zn+H2SO4=ZnSO4+H2↑
65 2
3.25g X
65:2 =3.25g:Xg
解得:X=0.1g
(3)向第三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀,其实质是钡离子和硫酸根离子结合,生成硫酸钡沉淀,而硫酸根离子来自于稀硫酸,故此沉淀相当于硫酸与氯化钡反应生成。故只要计算出硫酸的质量就可以求出氯化钡的质量。
由于第一次和第二次反应时,硫酸是完全反应,可由此求出20g硫酸中的溶质质量。
设20g硫酸中的溶质质量为y
Zn + H2SO4 = ZnSO4 + H2↑
65 98
3.25g y
65:98=3.25g:y
解得y=4.9g
则20g硫酸的溶质的质量分数= ×100%=24.5%
×100%=24.5%
那么60.00g硫酸中溶质的质量=60.00×24.5%=14.7g
设与60.00g硫酸完全反应,需要氯化钡的质量为z
H2SO4+BaCl2=BaSO4↓+2HCl
98 208
14.7g z
98:208=14.7g:z
解得,z=31.2g
根据“所得沉淀的质量与BaCl2溶液质量的关系图所示”,所用的BaCl2溶液的质量为208克,则BaCl2溶液的溶质质量分数= ×100%=15%
×100%=15%
答:(1)该黄铜合金中,锌元素的质量分数38%;(2)第二次实验中放出气体的质量0.1g;
(3)BaCl2溶液的溶质质量分数15%。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:本题考查了图示和化学反应相结合的通过化学方程式进行计算,问题难度逐渐较大;解答本题的关键是能够从表格中找出数量关系,掌握反应的情况;对学生读图和理解图示的能力要求较高。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| 第一次 | 第二次 | 第三次 | |
| 剩余固体的质量/g | 16.75 | 13.50 | 12.40 |
(1)该黄铜合金中,锌元素的质量分数.
(2)第二次实验中放出气体的质量.
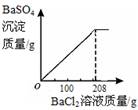
(3)向三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀.所得沉淀的质量与BaCl2溶液质量的关系如图所示,求所用BaCl2溶液的溶质质量分数.
黄铜是由铜和锌所组成的合金,用途广泛.某兴趣小组为探究黄铜合金的组成,取20.00g粉末状黄铜合金样品,把60.00g稀硫酸平均分成三等份,分三次加入样品中,均有气体产生,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
| 第一次 | 第二次 | 第三次 | |
| 剩余固体的质量/g | 16.75 | 13.50 | 12.40 |
(1)该黄铜合金中,锌元素的质量分数.
(2)第二次实验中放出气体的质量.
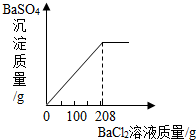
(3)向三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀.所得沉淀的质量与BaCl2溶液质量的关系如图所示,求所用BaCl2溶液的溶质质量分数.

| 第一次 | 第二次 | 第三次 | |
| 剩余固体的质量/g | 16.75 | 13.50 | 12.40 |
(1)该黄铜合金中,锌元素的质量分数.
(2)第二次实验中放出气体的质量.
(3)向三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀.所得沉淀的质量与BaCl2溶液质量的关系如图所示,求所用BaCl2溶液的溶质质量分数.