��Ŀ����
һ��ѧС��Ϊ�˲ⶨijͭ���м�ʽ̼��ͭ[Cu2��OH��2CO3]��������������ȡ��ͭ����Ʒ30g���ձ��У���ε�����������Ϊ10%��ϡ�������պ���ȫ��Ӧ������ȥϡ����146g��������ͭ���е����ʲ���ϡ���ᷴӦ��Ҳ������ˮ��
����
��1��ϡ������HCl�������Ƕ��ٿˣ�
��2��ͭ���м�ʽ̼��ͭ�������Ƕ��ٿˣ������������Ƕ��٣�
��3����Ӧ�������Ȼ�ͭ��Һ�����ʵ����������Ƕ��٣�
����Ӧ�Ļ�ѧ����ʽΪ��Cu2��OH��2CO3+4HCl�T2CuCl2+CO2��+3H2O����Ӧ�и����ʵ���Է���������Cu2��OH��2CO3��222
HCl��36.5 CuCl2��135 CO2��44 H2O��18��
ϡ������HCl����������Ϊ14.6�ˣ�ͭ���м�ʽ̼��ͭ��������22.2�ˣ���������Ϊ74%����Ӧ����Һ�����ʵ���������Ϊ16.5%��
��������
�����������1��ϡ������HCl������=146�ˡ�10%=14.6�ˣ�
��2����ͭ���м�ʽ̼��ͭ������ΪX�����ɵ��Ȼ�ͭ������ΪY��������̼������ΪZ��
Cu2��OH��2CO3+4HCl�T2CuCl2+CO2��+3H2O
222 146 270 44
X 14.6�� Y Z
 �T
�T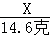
�ã�X�T22.2��
 �T
�T
y�T27��
 �T
�T
�ã�Z=4.4��
��ͭ���м�ʽ̼��ͭ����������= ��100%�T74%��
��100%�T74%��
��3�����ݣ�2�������֪����Ӧ����Һ������=22.2��+146�˩�4.4��=163.8�ˣ�
�෴Ӧ��������Һ����������= =16.5%��
=16.5%��
��ϡ������HCl����������Ϊ14.6�ˣ�ͭ���м�ʽ̼��ͭ��������22.2�ˣ���������Ϊ74%����Ӧ����Һ�����ʵ���������Ϊ16.5%��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�й��������������ļ��㣮

 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�