题目内容
(2012?宝应县二模)如图是工业生产纯碱的工艺流程示意图.
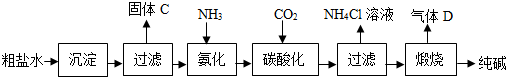
已知:①粗盐水中含有MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解.
完成下列填空:
(1)粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(3)“碳酸化”后过滤获得的NH4Cl可用作
(4)“煅烧”时,NaHCO3分解生成的气体D是
(5)鉴别产品纯碱中是否含有碳酸氢钠的方法是

已知:①粗盐水中含有MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解.
完成下列填空:
(1)粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为
Mg(OH)2和CaCO3
Mg(OH)2和CaCO3
,书写其中一个反应的化学方程式2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或Na2CO3+CaCl2=CaCO3↓+2NaCl)
2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或Na2CO3+CaCl2=CaCO3↓+2NaCl)
;(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
有利于溶液吸收CO2气体
有利于溶液吸收CO2气体
,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
.(3)“碳酸化”后过滤获得的NH4Cl可用作
氮
氮
肥,也可先加热
加热
(填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是NH3
NH3
;(4)“煅烧”时,NaHCO3分解生成的气体D是
CO2
CO2
,若将气体D直接排入空气不合理的理由是可循环利用,降低生产成本,同时也能保护环境
可循环利用,降低生产成本,同时也能保护环境
.(5)鉴别产品纯碱中是否含有碳酸氢钠的方法是
取样,加热,将可能产生的气体通入澄清石灰水,观察溶液是否变浑浊
取样,加热,将可能产生的气体通入澄清石灰水,观察溶液是否变浑浊
.分析:(1)本题给出了除去杂质应选用的试剂,NaOH和MgCl2反应生成氢氧化镁沉淀和氯化钠,Na2CO3和CaCl2反应生成CaCO3沉淀和NaCl;
(2)根据氨气溶于水溶液显碱性,二氧化碳的性质进行解答;
(3)根据NH4Cl的溶解性解答;
(4)根据二氧化碳属温室气体,还能循环使用二氧化碳节约资源分析;
(5)碳酸氢钠受热分解产生能使澄清石灰水变浑浊的二氧化碳气体.
(2)根据氨气溶于水溶液显碱性,二氧化碳的性质进行解答;
(3)根据NH4Cl的溶解性解答;
(4)根据二氧化碳属温室气体,还能循环使用二氧化碳节约资源分析;
(5)碳酸氢钠受热分解产生能使澄清石灰水变浑浊的二氧化碳气体.
解答:解:(1)NaOH和MgCl2反应生成Mg(OH)2沉淀和NaCl,Na2CO3和CaCl2反应生成CaCO3沉淀和NaCl;NaOH和MgCl2、Na2CO3和CaCl2反应的化学方程式为:
2NaOH+MgCl2=Mg(OH)2↓+2NaCl Na2CO3+CaCl2=CaCO3↓+2NaCl;
故答案是:Mg(OH)2和CaCO3;2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或Na2CO3+CaCl2=CaCO3↓+2NaCl);
(2)氨气溶于水溶液显碱性,有利于二氧化碳的吸收;NaCl、NH3、CO2 和H2O相互作用析出NaHCO3的化学方程式是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
故答案是:有利于溶液吸收CO2气体;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)农作物生长需大量的N、P、K元素,含有N元素的肥料属于氮肥;所以“碳酸化”后过滤获得的NH4Cl可用作氮肥;NH4Cl在加热的条件下分解为氨气和氯化氢:NH4Cl
NH3↑+HCl↑,该反应中生成的氨气(NH3)可以利用在工业生产纯碱工艺流程中的“氨化”环节;
故答案是:氮;加热;NH3;
(4)二氧化碳属温室气体,还能循环使用二氧化碳节约资源,故答案:可循环利用,降低生产成本,同时也能保护环境(答案合理即可);
(5)碳酸氢钠受热分解:2NaHCO3
Na2CO3+H2O+CO2↑,二氧化碳能使澄清的石灰水变浑浊,所以取该物质的样品加热,将产生的气体气体通入澄清石灰水,若溶液变浑浊则该物质是碳酸氢钠;
故答案是:取样,加热,将可能产生的气体通入澄清石灰水,观察溶液是否变浑浊.
2NaOH+MgCl2=Mg(OH)2↓+2NaCl Na2CO3+CaCl2=CaCO3↓+2NaCl;
故答案是:Mg(OH)2和CaCO3;2NaOH+MgCl2=Mg(OH)2↓+2NaCl(或Na2CO3+CaCl2=CaCO3↓+2NaCl);
(2)氨气溶于水溶液显碱性,有利于二氧化碳的吸收;NaCl、NH3、CO2 和H2O相互作用析出NaHCO3的化学方程式是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
故答案是:有利于溶液吸收CO2气体;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)农作物生长需大量的N、P、K元素,含有N元素的肥料属于氮肥;所以“碳酸化”后过滤获得的NH4Cl可用作氮肥;NH4Cl在加热的条件下分解为氨气和氯化氢:NH4Cl
| ||
故答案是:氮;加热;NH3;
(4)二氧化碳属温室气体,还能循环使用二氧化碳节约资源,故答案:可循环利用,降低生产成本,同时也能保护环境(答案合理即可);
(5)碳酸氢钠受热分解:2NaHCO3
| ||
故答案是:取样,加热,将可能产生的气体通入澄清石灰水,观察溶液是否变浑浊.
点评:本题考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力.书写化学方程式时,要注意质量守恒定律.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目