题目内容
【题目】某兴趣小组的同学为探究金属的化学性质以及锈蚀的条件进行了以下系列实验,仔细分析后回答下列问题:
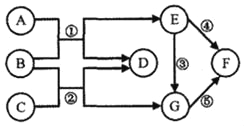
(1)实验一:小明按图所示以“金属表面产生气泡的快慢”为标准来判断锌、铝、铁的活动性强弱,有同学认为不够合理,理由是__________;铝与稀盐酸刚接触时反应缓慢,一段时间后剧烈,产生气泡速率随着加快,其原因可能是__________;三种金属活动性由强到弱顺序为__________(写元素符号)。

(2)实验二:为探究铁、铜、银三种金属活动性的顺序,小红提出按图2进行两步实验, a.试管①中发生反应的化学方程式为_______________; b.试管②中现象是_________。
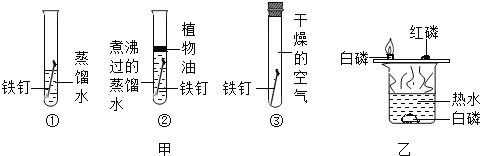
(3)铁是目前世界年产量最多的金属。如图是一氧化碳还原氧化铁实验装置图,回答下列问题

①写出甲处玻璃管中反应的化学方程式: ____________________;
②加热氧化铁之前,先通一会儿一氧化碳的作用是___________;
③该实验设计装置丙的目的是____________________。
【答案】选取酸的种类不同 铝表面的氧化膜没有完全去掉 Al、Zn、Fe Fe+CuSO4=FeSO4+Cu 铜片表面有银白色物质生成,溶液由无色逐渐变为蓝色 Fe2O3+3CO![]() 2Fe+3CO2 排尽试管内空气,防止加热时发生爆炸 处理尾气,防止一氧化碳污染空气
2Fe+3CO2 排尽试管内空气,防止加热时发生爆炸 处理尾气,防止一氧化碳污染空气
【解析】
(1)用控制变量法来探究金属的活动性强弱,金属片的形状、厚薄应该完全相同,应该选择同浓度、同体积的同一种酸,故填选取酸的种类不同;铝片表面有一层致密、结实的氧化铝薄膜,稀盐酸先与氧化铝反应,然后再与铝发生反应产生氢气,故填铝表面的氧化膜没有完全去掉;根据金属活动性顺序可知,三种金属的活动性顺序是铝、锌、铁,故填 Al、Zn、Fe;
(2)
a、试管①中铁能置换出硫酸铜中的铜,同时生成硫酸亚铁,方程式故填Fe+CuSO4=FeSO4+Cu;
b、试管②中铜片置换出硝酸银中的银,同时生成硝酸铜,实验现象是铜片表面有银白色物质生成,溶液由无色逐渐变为蓝色,故填铜片表面有银白色物质生成,溶液由无色逐渐变为蓝色;
(3)
①一氧化碳还原氧化铁生成铁和二氧化碳,方程式故填Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
②加热氧化铁之前,先通一会儿一氧化碳以排尽试管内空气,防止一氧化碳和空气混合加热发生爆炸,故填排尽试管内空气,防止加热时发生爆炸;
③一氧化碳有毒,是大气污染物,一氧化碳能燃烧生成二氧化碳,装置丙用一燃着的酒精灯将一氧化碳点燃,生成二氧化碳,避免了空气污染,故填处理尾气,防止一氧化碳污染空气。

【题目】某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取一定量的该样品放入烧杯中,再取60克稀盐酸分六次加入烧杯中,均充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
(1)第_____次试验,盐酸和样品恰好完全反应。
(2)该黄铜样品中铜的质量分数为_____。
(3)最后烧杯中剩余物的总质量为多少_____ g?