题目内容
【题目】化学实验是进行科学探究的重要方式.
(1)下列实验仪器中不能用于加热的是_____.
A.烧杯B.量筒C.试管D.蒸发皿
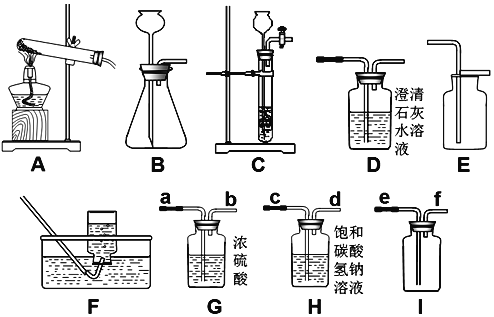
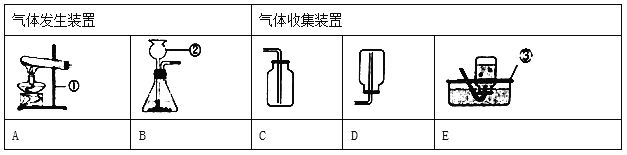
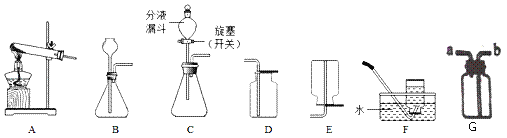
(2)某化学实验小组选用以下装置进行探究实验,①选择A,F组合一套装置制取了某气体,请写出有关反应的化学方程式_____.
②实验室制取CO2的化学方程式为_____;其发生装置可选择B或C,与B相比较,C的主要优点是什么?_____
③若用金属与酸反应来制取氢气,应选择以上哪些装置?_____(写出一套即可)
④若用如图G装置采用排水法收集H2,请简述操作步骤_____.
⑤用化学方程式表示检验二氧化碳原理_____.
(3)钛和钛合金性能优良,广泛用于航空、造船和化学工业.工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛,若用该方法制取2.4kg钛,理论上需要用钠的质量是_______?
【答案】 B 2KClO3![]() 2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以控制反应的速率 发生装置B或C,收集装置选E(或F) 集气瓶中注满水,插入带导管的橡皮塞,向导气管a通入H2,直至排净集气瓶中的水 CO2+Ca(OH)2 ═CaCO3↓+H2O 4.6kg
2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以控制反应的速率 发生装置B或C,收集装置选E(或F) 集气瓶中注满水,插入带导管的橡皮塞,向导气管a通入H2,直至排净集气瓶中的水 CO2+Ca(OH)2 ═CaCO3↓+H2O 4.6kg
【解析】(1)熟悉常见仪器的用途及注意事项;(2)①根据发生装置是固体加热型且试管口没有棉花并采用排水法收集适合于分解氯酸钾和二氧化锰的混合物制取氧气分析解答;②根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳解答;根据装置的特点分析解答;③根据反应物的状态,反应条件及生成气体的密度、溶解性分析解答;④根据排水集气瓶法的正确操作进行分析;⑤二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水;(3)利用化学方程式,根据反应的质量比即可计算出钠的质量。(1)烧杯在加热时需要垫上石棉网,试管和蒸发皿可直接加热,量筒不能加热,故选B;(2)①氯酸钾在二氧化锰的催化下并加热生成氯化钾和氧气,反应的化学方程式为2KClO3 ![]() 2KCl+3O2↑;②碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;其发生装置可选择B或C,与B相比较,C的主要优点是通过分液漏斗的阀门可以控制反应的速率;③用金属与酸反应来制取氢气,可以选择固液混合常温型发生装置B或C;由于氢气的密度比空气小,可以选择向下排空气法收集,即选择E装置,氢气难溶于水,也可以选择排水法收集,即选择F装置收集;④若用如图G装置采用排水法收集H2,操作步骤是:集气瓶中注满水,插入带导管的橡皮塞,向导气管a通入H2,直至排净集气瓶中的水;⑤二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2 ═CaCO3↓+H2O;
2KCl+3O2↑;②碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;其发生装置可选择B或C,与B相比较,C的主要优点是通过分液漏斗的阀门可以控制反应的速率;③用金属与酸反应来制取氢气,可以选择固液混合常温型发生装置B或C;由于氢气的密度比空气小,可以选择向下排空气法收集,即选择E装置,氢气难溶于水,也可以选择排水法收集,即选择F装置收集;④若用如图G装置采用排水法收集H2,操作步骤是:集气瓶中注满水,插入带导管的橡皮塞,向导气管a通入H2,直至排净集气瓶中的水;⑤二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2 ═CaCO3↓+H2O;
(3)设理论上需要钠的质量为x。
TiCl4+ 4Na![]() 4NaCl + Ti
4NaCl + Ti
92 48
x2.4kg
![]()
x=4.6kg
答:理论上需要钠的质量为4.6kg。