题目内容
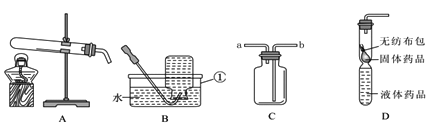
【题目】根据下图装置,用所学知识回答下列问题:

(1)请写出仪器b名称___________;
(2)实验室用高锰酸钾制取氧气,反应发生的化学方程式为:___________________;应选用的发生装置为; __________(填字母),收集装置为_____(填字母),检验是否收集满的方法是:____________________________________________;
(3)同学又用上述装置制取二氧化碳,他选用的装置组合是:___________,他将制取的二氧化碳通入澄清石灰水中,发现石灰水变浑浊,发生的化学方程式为; ________。
【答案】 集气瓶 ![]() A CD 用带火星的木条放在集气瓶口,若木条复燃, 则证明氧气已满 B Ca(OH)2 + CO2 =CaCO3↓ +H2O
A CD 用带火星的木条放在集气瓶口,若木条复燃, 则证明氧气已满 B Ca(OH)2 + CO2 =CaCO3↓ +H2O
【解析】(1)仪器b是试管(2)用高锰酸钾制取氧气,反应发生的化学方程式为:2KMnO4△ K2MnO4+MnO2+O2↑,加热固体制取气体选择装置A,氧气不易溶于水,可用排水法收集,氧气的密度比空气的密度大,可用向上排空气法收集,故选C或D。检验氧气是否收集满的方法是:将带火星的木条放在集气瓶口,若木条复燃, 则证明氧气已满。(3)固液常温反应制取气体选择装置B,二氧化碳能使澄清石灰水变浑浊,Ca(OH)2 + CO2 =CaCO3↓ +H2O。

 阅读快车系列答案
阅读快车系列答案【题目】某石油化工厂化验室的实验员用20%的氢氧化钠溶液洗涤一定量石油产品中的残余稀硫酸,测得实验数据如表:
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号 的数据。
(2)当PH》7时,溶液中的溶质是 。
(3)若一定量石油产品中残余稀硫酸的质量为100g,请计算该残余稀硫酸的溶质质量分数。(写 出详细的计算过程)