题目内容
【题目】向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。问:
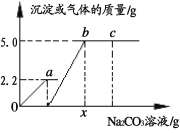
(1)图中0a段表示生成______________(“气体”还是“沉淀”)的过程;
(2)b点溶液中溶质有_______种;
(3)c点溶液的pH__________7 (填>、<、=) ;
(4) x值是多少?(写出具体的计算过程)
【答案】(1)气体;
(2)一种溶质;
(3)pH>7;
(4)
【解析】
试题分析:(1)根据酸碱盐间反应的先后顺序控制,加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了;
(2)b点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质;
(3)c点的溶液中含有Na2CO3、NaCl两种溶质,由于Na2CO3显碱性,NaCl显中性,所以c的溶液的pH>7;
(4)根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀5.0g所需Na2CO3的质量为z.则
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106 44
y 2.2g
106/44 =y/2.2g
y=5.3g g
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
Z 5.0g
106/100=z/5g
Z=5.3g
X=(5.3g+5.3g)/10% =106g
答:略

练习册系列答案
相关题目