题目内容
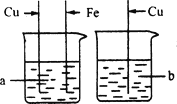
【题目】某化学小组用一定量AgNO3和Cu(NO3) 2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和实验探究。
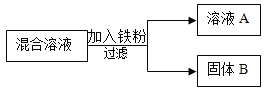
(1)在过滤操作中所用到的玻璃仪器有烧杯、玻璃棒和______。
(2)写出探究过程中任一反应的化学方程式______。
(3)若溶液A为蓝色,请分析固体B的成分______。
【答案】漏斗 Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+Cu(NO3)2=Fe(NO3)2+Cu Ag或Ag和Cu
【解析】
(1)根据过滤时所用仪器可知,必须用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(2)AgNO3和Cu(NO3)2混合溶液中加入与铁粉,铁先和硝酸银反应生成银和硝酸亚铁,硝酸银反应完全后,铁和硝酸铜反应生成硝酸亚铁和铜;反应的化学方程式为Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+Cu(NO3)2=Fe(NO3)2+Cu;
(3)若溶液A为蓝色,则溶液A中含有硝酸铜,所以Cu(NO3)2没有反应或部分发生反应,所以反应后固体B可能是Ag或Ag和Cu。
故填:(1)漏斗;(2)Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+Cu(NO3)2=Fe(NO3)2+Cu;(3)Ag或Ag和Cu。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
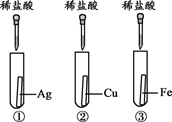
【题目】为探究金属的化学性质,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是_____________________。
(3)有一只试管中的物质能与稀盐酸反应,原因是_________________________ 。